按要求书写
( 1 )铁与水蒸气反应的化学方程式: ___________
( 2 )向 FeSO 4 溶液中滴入 NaOH 溶液的实验现象: ___________
( 3 )用单线桥标出电子转移方向和数目: ___________ KClO 3 + 6HCl = KCl + 3Cl 2 ↑+ 3H 2 O
( 4 )配平方程式: ___________ Cu 2 S + HNO 3 — Cu ( NO 3 ) 2 + NO ↑ + S + H 2 O (将配平系数依次填入答题卡空格)
答案
3Fe + 4H 2 O ( g ) Fe 3 O 4 + 4H 2 产生白色沉淀,迅速变成灰绿色,最后变为红褐色
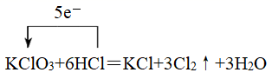 3Cu 2 S + 16HNO 3 = 6Cu ( NO 3 ) 2 + 4NO ↑+ 3S + 8H 2 O
3Cu 2 S + 16HNO 3 = 6Cu ( NO 3 ) 2 + 4NO ↑+ 3S + 8H 2 O
【详解】
( 1 )铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为 3Fe + 4H 2 O ( g ) Fe 3 O 4 + 4H 2 ;
( 2 )向 FeSO 4 溶液中滴入 NaOH 溶液生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化为氢氧化铁,则实验现象为产生白色沉淀,迅速变成灰绿色,最后变为红褐色;
( 3 ) KClO 3 + 6HCl = KCl + 3Cl 2 ↑+ 3H 2 O 中,盐酸中氯元素化合价从- 1 价升高到 0 价,氯酸钾中氯元素化合价从 + 5 价降低到 0 价,则用单线桥标出电子转移方向和数目为 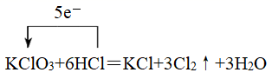 ;
;
( 4 )铜元素化合价从+ 1 价升高到 + 2 价,硫元素化合价从- 2 价升高到 0 价,氮元素化合价从 + 5 价降低到 + 2 价,则根据电子得失守恒和原子守恒可知配平后的方程式为 3Cu 2 S + 16HNO 3 = 6Cu ( NO 3 ) 2 + 4NO ↑+ 3S + 8H 2 O 。



