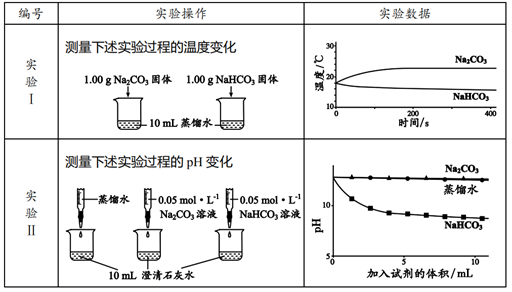
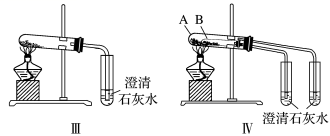
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图 Ⅰ ~ Ⅳ 所示 ( 部分夹持装置已略去 ) 。

(1) 图 Ⅰ 、 Ⅱ 所示实验中能够达到实验目的的是 _______ ( 填序号 ) 。
(2) 图 Ⅲ 、 Ⅳ 所示实验均能鉴别这两种物质,其反应的化学方程式为 _______ 。
(3) 若用实验 Ⅳ 验证碳酸钠和碳酸氢钠的稳定性,则试管 B 中装入的固体最好是 _______ ( 填化学式 ) 。
(4) 将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当澄清石灰水过量时,反应的离子方程式为 _______ 。
②当碳酸氢钠与氢氧化钙的物质的量之比为 2 ∶ 1 时,所得溶液中溶质的化学式为 _______ ,请设计实验检验所得溶液中溶质的阴离子: _______ 。
答案
Ⅱ 2NaHCO 3 Na 2 CO 3 +CO 2 ↑ +H 2 O 、 CO 2 +Ca(OH) 2 =CaCO 3 ↓ +H 2 O NaHCO 3 Ca 2+ +OH - +HCO
= CaCO 3 ↓ +H 2 O Na 2 CO 3 取少量上层清液与洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根
【详解】
(1) 盐酸和碳酸钠或碳酸氢钠固体反应时都可以产生二氧化碳,使澄清石灰水变浑浊,所以图 Ⅰ 不能达到实验目的;而等质量的碳酸钠和碳酸氢钠和足量盐酸反应,碳酸氢钠与盐酸反应生成的二氧化碳更多,更快,现象不同,所以图 Ⅱ 中可以根据气球的膨胀速率和膨胀程度来鉴别二者,可以达到实验目的;
(2) 碳酸钠较稳定,受热不分解,碳酸氢钠不稳定受热易分解生成碳酸钠、水和二氧化碳,化学方程式为 2NaHCO 3 Na 2 CO 3 +CO 2 ↑ +H 2 O ,生成的二氧化碳和澄清石灰水反应生成碳酸钙,化学方程式为 CO 2 +Ca(OH) 2 =CaCO 3 ↓ +H 2 O ;
(3) 试管 B 中装入碳酸氢钠,试管 A 中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,更能表明碳酸氢钠的不稳定;
(4) ①澄清石灰水过量时,氢氧根不能完全反应,离子方程式为 Ca 2+ +OH - +HCO = CaCO 3 ↓ +H 2 O ;
②当碳酸氢钠与氢氧化钙的物质的量之比为 2 ∶ 1 时,发生的反应为 2NaHCO 3 +Ca(OH) 2 = CaCO 3 ↓ +Na 2 CO 3 +2H 2 O ,则所得溶液的溶质为 Na 2 CO 3 ,阴离子为 CO ,检验碳酸根,可以取少量上层清液与洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有碳酸根。