常温下,一氧化二氯 (C1 2 O) 为棕黄色气体,熔点为﹣ 116℃ ,浓度过高时易分解爆炸。为降低风险和便于贮存,制出 C1 2 O 后,一般将其 “ 固化 ” 为固态。某小组按以下两阶段制备 C1 2 O 。回答下列问题:
第一阶段:制备 HgO 。
配制 15 %的 NaC1 溶液和 30 %的 HgC1 2 溶液,将二者以一定质量比混合得到 5 % NaC1 和 20 % HgC1 2 的混合液;在室温下,边搅拌边缓慢地向混合液中加入过量 NaOH 溶液,生成黄色沉淀;将沉淀反复洗涤数次,直至没有氯离子;真空抽滤后将沉淀物在暗处干燥,得到干燥的 HgO 。
(1) 配制 15 % NaC1 溶液,除用到托盘天平和烧杯、玻璃棒外,还需要的玻璃仪器有 ___________ 。
(2) 配制混合液时, 15 % NaC1 溶液和 30 % HgC1 2 溶液的质量比为 ___________ 。
(3) 检验沉淀已经洗涤至没有氯离子的操作及现象为 ___________ 。
第二阶段:制备 C1 2 O 。
制备干燥、纯净的 C1 2 ;然后在干燥氮气的气流中,用 C1 2 和 HgO 在 18 ~ 20℃ 条件下制备 C1 2 O ;将产生的 C1 2 O 气体 “ 固化 ” ;最后进行尾气处理。
(4) 将干燥、纯净的 C1 2 通入下面装置中制备 C1 2 O 并 “ 固化 ” 。
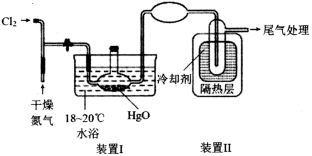
①制备 C1 2 O 时还得到了 HgC1 2 ·HgO 固体,则装置 I 中制备反应的化学方程式为 ___________ 。干燥氮气的作用除将产生的 C1 2 O 送入后续装置 “ 固化 ” 外,还有 ___________ 。
②常用冷却剂的数据如下表。 “ 固化 ” 时装置 II 中的冷却剂为 ___________ ( 填标号 ) 。
| 物质 | O 2 | CO 2 | NH 3 | Cl 2 |
| 熔点 /℃ | -218.4 | -78.5 | -77.3 | -101 |
| 沸点 /℃ | -183 | 升华 | -33.35 | -34.6 |
A .液氯 B .液氨 C .干冰 D .液氧
答案
量筒、胶头滴管 1 ∶ 2 取少量最后一次洗涤液于试管中,滴加 AgNO 3 溶液,无沉淀产生 2Cl 2 + 2HgO HgCl 2 ·HgO + Cl 2 O 稀释 Cl 2 O ,防止 Cl 2 O 浓度过高分解爆炸 D
【详解】
( 1 )配制 15% 的食盐溶液,首先计算配制溶液所需食盐和水的质量,再称量所需的食盐和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒,故还需要的玻璃仪器有量筒、胶头滴管等;
(2) 配制 15 %的 NaC1 溶液和 30 %的 HgC1 2 溶液,将二者以一定质量比混合得到 5 % NaC1 和 20 % HgC1 2 的混合液;质量分数分别为原来的 和
,故配制混合液时, 15 % NaC1 溶液和 30 % HgC1 2 溶液的质量比为
:
=1 : 2 ;
(3) 利用硝酸银溶液检验氯离子的存在,则检验沉淀已经洗涤至没有氯离子的操作及现象为取少量最后一次洗涤液于试管中,滴加 AgNO 3 溶液,无沉淀产生;
(4) ①将干燥、纯净的 C1 2 通入 HgO 固体中且水浴加热,制备 C1 2 O 时还得到了 HgC1 2 ·HgO 固体,则装置 I 中制备反应的化学方程式为 2Cl 2 + 2HgO HgCl 2 ·HgO + Cl 2 O ;
干燥氮气的作用除将产生的 C1 2 O 送入后续装置 “ 固化 ” 外,还有稀释 Cl 2 O ,防止 Cl 2 O 浓度过高分解爆炸;
②常用冷却剂的数据如下表。根据一氧化二氯 (C1 2 O) 的熔点为﹣ 116℃ ,故 “ 固化 ” 时装置 II 中的冷却剂应低于其温度,故应选液氧,答案选 D 。



 N2+3Cu+3H2O
N2+3Cu+3H2O