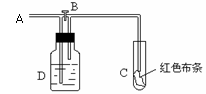
工业上,向 500 ~ 600 ℃的铁屑中通入氯气生产氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。回答下列问题:

( 1 )制取无水氯化铁的实验中, A 中反应的化学方程式为 ___________ ,装置 B 中加入的试剂是 ___________ 。若 D 中盛放的是 NaOH 溶液,则发生反应的离子方程式为 ___________ 。
( 2 )制取无水氯化亚铁的实验中,装置 A 用来制取 ___________ ,尾气的成分是 ___________ 。若仍用 D 装置进行尾气处理,存在的问题是易发生倒吸和 ___________ 。
( 3 )欲制得纯净的 FeCl 2 ,在实验操作中应先点燃 ___________ 处 (填“ A ”或“ C ”)的酒精灯,理由是 ___________ 。
答案
MnO 2 + 4HCl (浓) MnCl 2 + Cl 2 ↑+ 2H 2 O 浓硫酸 Cl 2 + 2OH - = Cl - + ClO - + H 2 O HCl HCl 和 H 2 可燃性气体 H 2 不能被吸收 A 利用制取的 HCl 排尽装置内的空气,防止铁被氧化
【分析】
由制备氯化铁的实验装置可知, A 中浓盐酸与二氧化锰反应生成氯气, B 中浓硫酸干燥氯气, C 中 Fe 与氯气反应生成氯化铁, D 中 NaOH 溶液吸收尾气;
制备氯化亚铁时, A 用来产生 HCl , B 用来干燥 HCl ,干燥的 HCl 和铁屑在 C 中反应制得氯化亚铁。
【详解】
( 1 )制取无水氯化铁的实验中, A 中制备氯气,反应的化学方程式为 MnO 2 + 4HCl (浓) MnCl 2 + Cl 2 ↑+ 2H 2 O ,装置 B 用来干燥氯气,其中加入的试剂是浓硫酸; D 中盛放的是 NaOH 溶液,用来吸收尾气,则发生反应的离子方程式为 Cl 2 + 2OH - = Cl - + ClO - + H 2 O ;
( 2 )制取无水氯化亚铁的实验中,装置 A 用来制取 HCl , Fe 与 HCl 反应生成氢气,可知尾气的成分是 HCl 和 H 2 ;氯化氢极易溶于水,氢氧化钠不能吸收氢气,因此若仍用 D 的装置进行尾气处理,存在的问题是发生倒吸、可燃性气体 H 2 不能被吸收;
( 3 )在加热的条件下铁和氧气反应,为防止铁被氧化,应利用制取的 HCl 排尽装置内的空气,所以在实验操作中应先点燃 A 的酒精灯。




 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO