叠氮酸钠 (NaN 3 ) 是重要的化工原料。以甲醇、亚硝酸钠等为原料制备 NaN 3 流程如下:
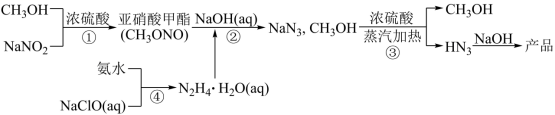
已知水合肼 (NH 4 ·H 2 O) 不稳定,具有强还原性。下列描述错误的是
A . 反应 ①和反应③中浓硫酸作用不同
B . 反应 ②的化学方程式:
C . 步骤 ③分离出的 CH 3 OH 可导入 ①中循环利用
D . 反应 ④制备水合肼时应将氨水逐滴滴入 NaClO 溶液中
答案
D
【分析】
由题给流程可知,向甲醇、亚硝酸钠的混合物中加入浓硫酸,浓硫酸先与亚硝酸钠反应生成亚硝酸,在浓硫酸做催化剂和脱水剂的作用下,甲醇与亚硝酸发生酯化反应生成亚硝酸甲酯;氨水和次氯酸钠溶液混合发生氧化还原反应得到水合肼,在氢氧化钠溶液中,亚硝酸甲酯与水合肼发生氧化还原反应生成叠氮酸钠、甲醇和水,在蒸汽加热的条件下,向反应后的溶液中加入浓硫酸,浓硫酸与叠氮酸钠反应制得叠氮酸,叠氮酸与氢氧化钠溶液反应制得产品叠氮酸钠。
【详解】
A .由分析可知,反应 ① 中浓硫酸起酸、催化剂和脱水剂的作用,反应 ③ 中浓硫酸只起酸的作用,作用不同,故 A 正确;
B .由分析可知,反应 ② 为在氢氧化钠溶液中,亚硝酸甲酯与水合肼发生氧化还原反应生成叠氮酸钠、甲醇和水,反应的化学方程式为 ,故 B 正确;
C .由分析可知,反应 ① 中甲醇做反应物,则步骤 ③ 分离出的 甲醇可导入 ① 中循环利用,故 C 正确;
D .水合肼具有强还原性,若反应 ④ 制备水合肼时应将氨水逐滴滴入具有强氧化性的次氯酸钠溶液中,水合肼会与次氯酸钠溶液发生氧化还原反应,而无法制得水合肼,故 D 错误;
故选 D 。


