工业上,从精制黑钨矿 (FeWO 4 、 MnWO 4 ) 中提取金属钨的一种流程如下图所示,该流程同时获取副产物 Fe 2 O 3 和 MnCl 2 。
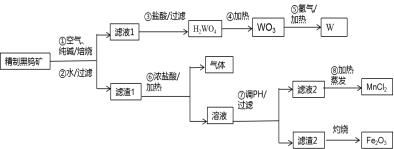
已知: I .过程 ① ~ ④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ. 25 ℃时, ![]()
回答下列问题:
( 1 )上述流程中的 “ 滤渣 1” 除 MnO 2 外还有 _____ 、 “ 气体 ” 除水蒸气、 HCl 外还有 ____ ( 均填化学式 ) ;
( 2 )过程 ①中 MnWO 4 参与反应的化学方程式为 ______ ; FeWO 4 参与的反应中氧化剂与还原剂的物质的量之比为 ___________ ;
( 3 )已知 WO 3 (s)+3H 2 (g)=W(s)+3H 2 O(g) ΔH=a kJ·mol - 1
WO 3 (s)=WO 3 (g) ΔH=b kJ·mol - 1
写出 WO 3 (g) 与 H 2 (g) 反应生成 W(s) 的热化学方程式: _______ ;
( 4 )过程 ⑦在 25 ℃时调 pH ,至少应调至 _______ ( 当离子浓度等于 1.0×10 - 5 mol·L - 1 时,可认为其已沉淀完全 ) ;
( 5 )过程 ⑧要获得 MnCl 2 固体,在加热时必须同时采取的一项措施是 __________ ;
( 6 )钠钨青铜是一类特殊的非化学计量比化合物,其通式为 Na x WO 3 ,其中 0<x<1 ,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的 Na 2 WO 4 和 WO 2 混合物可以制备钠钨青铜,写出 WO 4 2- 在阴极上放电的电极反应式: ___________ 。
答案
Fe 2 O 3 Cl 2 2MnWO 4 +2Na 2 CO 3 +O 2 ![]() 2Na 2 WO 4 +2MnO 2 +2CO 2 1:4 WO 3 (g)+3H 2 (g)=W(s)+3H 2 O(g) Δ H=(a-b)kJ · mol -1 3.0 通入 HCl 气体,在 HCl 气氛中加热 WO 4 2- +xe - =WO 3 x- +O 2-
2Na 2 WO 4 +2MnO 2 +2CO 2 1:4 WO 3 (g)+3H 2 (g)=W(s)+3H 2 O(g) Δ H=(a-b)kJ · mol -1 3.0 通入 HCl 气体,在 HCl 气氛中加热 WO 4 2- +xe - =WO 3 x- +O 2-
【分析】
紧扣工业流程中物质种类的变化、核心元素化合价的变化,判断物质成分,并书写化学方程式;根据盖斯定律,由已知热化学方程式可求目标热化学方程式;利用溶度积常数计算离子完全沉淀时的 pH ;从平衡移动原理考虑抑制水解的措施;根据电解原理写电极反应式。
【详解】
(1) 据 “ 已知 I” 和化学式 H 2 WO 4 、 WO 3 知,黑钨矿 (FeWO 4 、 MnWO 4 ) 中 Fe 、 Mn 元素均为 +2 价,在步骤 ① 中分别被空气氧化为 Fe 2 O 3 、 MnO 2 ,即 “ 滤渣 1” 有 MnO 2 和 Fe 2 O 3 。 “ 滤渣 1” 与浓盐酸共热时, MnO 2 与 HCl 反应生成 Cl 2 ,另有浓盐酸挥发出 HCl 和水蒸气。
(2) 从步骤 ③ 看, “ 滤液 1” 中含有 Na 2 WO 4 。步骤 ①MnWO 4 中 Mn 被 O 2 氧化为 MnO 2 、 WO 4 2 - 与 Na 2 CO 3 生成 Na 2 WO 4 并放出 CO 2 ,由此写出方程式为 2MnWO 4 +2Na 2 CO 3 +O 2 ![]() 2Na 2 WO 4 +2MnO 2 +2CO 2 。 FeWO 4 被 O 2 氧化为 Fe 2 O 3 ,据化合价升降数相等,得氧化剂( O 2 )与还原剂( FeWO 4 )的物质的量之比为 1:4 。
2Na 2 WO 4 +2MnO 2 +2CO 2 。 FeWO 4 被 O 2 氧化为 Fe 2 O 3 ,据化合价升降数相等,得氧化剂( O 2 )与还原剂( FeWO 4 )的物质的量之比为 1:4 。
(3) 据盖斯定律,将两个已知热化学方程式相减,消去 WO 3 (s) 可得目标热化学方程式 WO 3 (g)+3H 2 (g)=W(s)+3H 2 O(g) ΔH=(a-b)kJ·mol -1 。
(4) 步骤 ⑥ 所得溶液中溶质有 MnCl 2 、 FeCl 3 ,步骤 ⑦ 调节 pH 使 Fe 3+ 完全沉淀而 Mn 2+ 不沉淀。当 c(Fe 3+ )=1.0×10 - 5 mol·L - 1 时,由 ![]() 得 c(OH - )=1.0×10 - 11 mol·L - 1 ,进而 c(H + )=1.0×10 - 3 mol·L - 1 , pH=3 。
得 c(OH - )=1.0×10 - 11 mol·L - 1 ,进而 c(H + )=1.0×10 - 3 mol·L - 1 , pH=3 。
(5) 步骤 ⑧ 要从 MnCl 2 溶液中获得 MnCl 2 固体,为抑制 Mn 2+ 水解,必须通入 HCl 气体、并在 HCl 气氛中加热。
(6)Na x WO 3 中阴离子为 WO 3 x- ,熔融的 Na 2 WO 4 和 WO 2 混合物中有 Na + 、 WO 4 2 - 、 W 4+ 、 O 2 - 。 WO 4 2 - 在电解池阴极得电子生成 WO 3 x- ,电极反应为 WO 4 2- +xe - =WO 3 x- +O 2- 。



