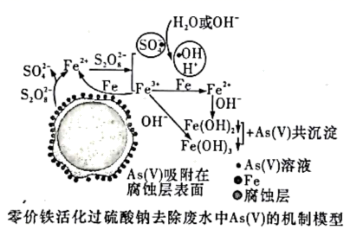
下列实验操作与现象不相匹配的是
| 实验操作 | 实验现象 | |
| A | 向盛有Ba(NO3)2溶液的试管中通入CO2 | 产生白色沉淀 |
| B | 向盛有KI溶液的试管中滴加氯水和CCl4液体,振荡 | 下层溶液变为紫红色 |
| C | 向盛有Na2S2O3溶液的试管中先滴入酚酞溶液,然后滴加盐酸,边滴边振荡。 | 溶液先变红后褪色,有气泡产生并出现浑浊 |
| D | 向盛有FeCl3溶液的试管中先加入足量锌粉,充分振荡后加2滴 | 溶液黄色逐渐消失,加 |
A.A B.B C.C D.D
答案
A
【详解】
A.向盛有Ba(NO3)2溶液的试管中通入CO2,相当于讨论H2CO3与Ba(NO3)2复分解反应能不能发生?用弱酸不能制强酸,不反应无现象,A项实验操作与现象不相匹配, A项错误;
B.向盛有KI溶液的试管中滴加氯水和CCl4液体, Br2+2KI =I2+2KBr,I2易溶于CCl4 显紫红色,B项操作与现象相匹配,B项正确;
C.由于硫代硫酸根离子水解溶液呈碱性,滴入酚酞溶液先变红,然后滴加盐酸溶液,发生反应 Na2S2O3+2HCl=SO2↑+S↓+2NaCl+H2O,反应后溶液呈中性,红色褪去,C项操作与现象相匹配,C项正确;
D.向盛有FeCl3溶液的试管中先加入足量锌粉,发生反应:Zn+2FeCl3═2FeCl2+ZnCl2,三价铁变二价铁溶液,溶液黄色逐渐消失,加![]() 溶液产生深蓝色沉淀,D项操作与现象相匹配,D项正确;
溶液产生深蓝色沉淀,D项操作与现象相匹配,D项正确;
答案选A。