我国科学家设计了一种智能双模式海水电池,满足水下航行器对高功率和长续航的需求。负极为Zn,正极放电原理如图。下列说法错误的是( )
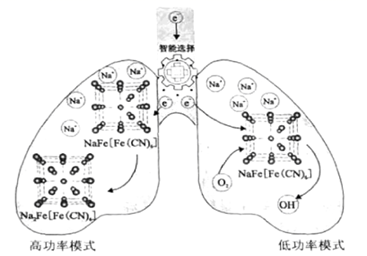
A.电池以低功率模式工作时,NaFe![]() 作催化剂
作催化剂
B.电池以低功率模式工作时,Na+的嵌入与脱嵌同时进行
C.电池以高功率模式工作时,正极反应式为:NaFe![]() +e-+Na+=Na2Fe
+e-+Na+=Na2Fe![]()
D.若在无溶解氧的海水中,该电池仍能实现长续航的需求
答案
D
【解析】
A.根据图示可知:电池以低功率模式工作时,负极是Zn-2e-=Zn2+,正极上是NaFe![]() 获得电子,然后与吸附在它上面的氧气即溶液中发生反应为O2+4e-+2H2O=4OH-,从NaFe
获得电子,然后与吸附在它上面的氧气即溶液中发生反应为O2+4e-+2H2O=4OH-,从NaFe![]() 上析出,故NaFe
上析出,故NaFe![]() 的作用是作催化剂,A正确;
的作用是作催化剂,A正确;
B.电池以低功率模式工作时,电子进入NaFe![]() 时Na+的嵌入;当形成OH-从NaFe
时Na+的嵌入;当形成OH-从NaFe![]() 析出时,Na+从NaFe
析出时,Na+从NaFe![]() 脱嵌,因此Na+的嵌入与脱嵌同时进行,B正确;
脱嵌,因此Na+的嵌入与脱嵌同时进行,B正确;
C.根据电池以高功率模式工作时,正极上NaFe![]() 获得电子被还原变为Na2Fe
获得电子被还原变为Na2Fe![]() ,所以正极的电极反应式为:NaFe
,所以正极的电极反应式为:NaFe![]() +e-+Na+=Na2Fe
+e-+Na+=Na2Fe![]() ,C正确;
,C正确;
D.若在无溶解氧的海水中,由于在低功率模式工作时需要氧气参与反应,因此在该电池不能实现长续航的需求,D错误;
故合理选项是D。



 B
B
 D
D