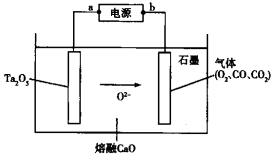
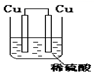
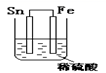
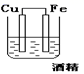
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.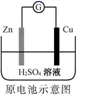 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 正极的电极反应式为Ag2O+2e−+H2O
正极的电极反应式为Ag2O+2e−+H2O![]() 2Ag+2OH−
2Ag+2OH−
C. 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D. 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
答案
A
【详解】
A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,H+氧化性较强,得电子变H2,因而c(H+)减小,A项错误;
B. Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e−+H2O![]() 2Ag+2OH−,B项正确;
2Ag+2OH−,B项正确;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项正确;
D.铅蓄电池总反应式为PbO2 + Pb + 2H2SO4 ![]() 2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
2PbSO4 + 2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
故答案选A。