碳酸亚铁可用于制备补血剂。某研究小组制备了 FeCO3,并对 FeCO3 的性质和应用进行了探究。
已知:①FeCO3 是白色固体,难溶于水②Fe2++6SCN-⇌Fe(SCN)64-(无色)
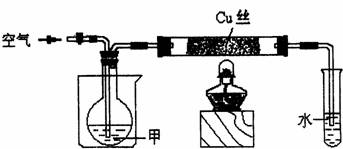
Ⅰ.FeCO3 的制取(夹持装置略)
实验i

装置 C 中,向 Na2CO3 溶液(pH=11.9)通入一段时间 CO2 至其 pH 为 7,滴加一定量 FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到 FeCO3 固体。
(1)试剂 a 是________。
(2)向 Na2CO3 溶液通入 CO2 的目的是________。
(3)C 装置中制取 FeCO3 的离子方程式为________。
Ⅱ.FeCO3 的性质探究
实验ii
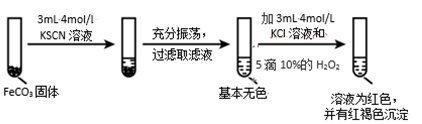
实验iii
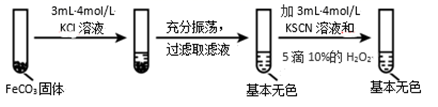
(4)对比实验ⅱ和ⅲ,得出的实验结论是________。
(5)依据实验ⅱ的现象,写出加入 10%H2O2 溶液的离子方程式________。
Ⅲ.FeCO3的应用
(6)FeCO3 溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为____。
(7)该实验小组用 KMnO4 测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 100%,其原因是____(不考虑操作不当引起的误差)。
答案
饱和 NaHCO3 溶液 降低溶液中OH-浓度,防止生成 Fe(OH)2 2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O Fe2+与 SCN—的络合(或结合)会促进 FeCO3 固体的溶解 6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN- FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO- +Fe2++CO2↑+H2O 乳酸根中的羟基被 KMnO4 氧化,也消耗了 KMnO4
【分析】
Ⅰ.装置A中碳酸钙和稀盐酸反应生成的CO2中混有挥发的HCl气体,需要利用装置B中盛装的饱和NaHCO3溶液除去,装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体;
Ⅱ.(4)根据Fe2++6SCN-![]() Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
Fe(SCN)64-分析FeCO3在KCl和KSCN两种不同溶液中的溶解度不同判断;
(5)实验ⅱ中溶液显红色且有红褐色沉淀生成,说明加入10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成;
Ⅲ.(6)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,可结合盐和酸反应生成新酸和新盐的反应原理分析;
(7)乳酸根中羟基也能被高锰酸钾溶液氧化。
【详解】
Ⅰ.(1)欲除去CO2中混有的HCl,则B中盛装的试剂a是饱和NaHCO3溶液,故答案为:饱和 NaHCO3溶液;
(2)向Na2CO3溶液通入CO2的目的是,利用碳酸钠和CO2反应生成的NaHCO3,提高溶液中HCO3-的浓度,抑制CO32-的水解,降低溶液中OH-浓度,防止生成Fe(OH)2,故答案为:降低溶液中OH-浓度,防止生成 Fe(OH)2;
(3)装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,此时溶液中溶质主要为NaHCO3,再滴加FeSO4溶液,有FeCO3沉淀生成,发生反应的离子方程式为2HCO3-+Fe2+=FeCO3+CO2↑+H2O,故答案为:2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;
Ⅱ. (4)通过对比实验ⅱ和ⅲ,可知Fe2+与SCN—的络合生成可溶于水的Fe(SCN)64-,会促进FeCO3固体的溶解,故答案为:Fe2+与 SCN—的络合(或结合)会促进 FeCO3 固体的溶解;
(5)依据实验ⅱ的现象,可知在含有Fe(SCN)64-的溶液中滴加10%H2O2溶液后有Fe(OH)3和Fe(SCN)3生成,发生反应的离子方程式为6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN,故答案为:6Fe(SCN)64- +3H2O2=2Fe(OH)3↓ +4Fe(SCN)3 +24SCN-;
Ⅲ. (6)FeCO3溶于乳酸制得可溶性乳酸亚铁补血剂,发生反应的离子方程式为FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O,故答案为:FeCO3+2CH3CH(OH)COOH=2CH3CH(OH)COO-+Fe2++CO2↑+H2O;
(7)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%,故答案为:乳酸根中的羟基被KMnO4 氧化,也消耗了KMnO4。