钴及其化合物有着广泛的应用前景。回答下列问题:
(1)基态Co原子的核外电子排布式为_________.
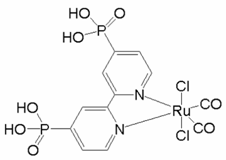
(2)以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构简式如图所示。
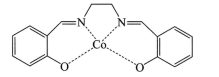
①配合物中提供孤对电子的原子是_________(填元素符号);
②该多齿配体中所含元素电负性由大到小的顺序为__________(填元素符号):
③下列化合物与上述配合物中C和N原子的杂化类型均相同的是__________(填标号)。
A.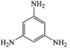 B.
B.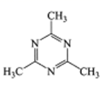
C.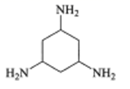 D.
D.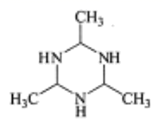
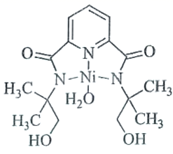
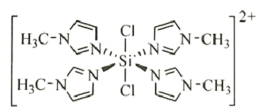
(3)亚硝酸钴钠可与K+结合形成![]() ,从而实现对K+的定量测定。
,从而实现对K+的定量测定。
①![]() 中存在的化学键类型有_________(填标号);
中存在的化学键类型有_________(填标号);
A.金属键 B.离子键 C.极性共价键 D.配位键
②与亚硝酸根互为等电子体的化合物有_________(写一种)。
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是____。
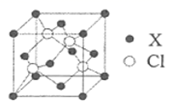
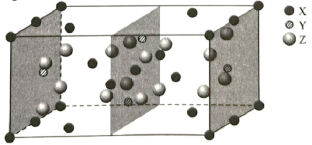
(5)某种铁酸钴(CoTiO3)晶胞沿x、y或z轴任意一个方向的投影如下图所示。晶胞中Co处于各顶角位置,则O处于_________位置,与Co紧邻的O的个数为_________。若晶胞中Co与O的距离为anm,阿伏加德罗常数的值为NA,该晶体的密度为_________g.cm-3(列出计算式)。

答案
![]() 或1s22s22p63s23p63d74s2 O、N O>N>C>H B BCD SO2或SnO2 Co原子半径小且价电子数多,金属键强 面心 12
或1s22s22p63s23p63d74s2 O、N O>N>C>H B BCD SO2或SnO2 Co原子半径小且价电子数多,金属键强 面心 12 ![]() 或
或![]() 或
或![]() 或
或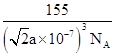
【分析】
根据均摊法和化合物的分子式确定氧原子的位置和与Co紧邻的O的个数,利用晶胞的质量和体积计算晶胞密度。
【详解】
(1)Co是27号元素,基态Co原子的核外电子排布式为![]() 或1s22s22p63s23p63d74s2;
或1s22s22p63s23p63d74s2;
(2)①根据配合物的结构和配位键的形成特点,配合物中提供孤对电子的原子是O、N;
②该多齿配体中所含元素为H、C、N、O,C、N、O位于同一周期,同周期元素从左到右电负性逐渐增强,故电负性由大到小的顺序为O>N>C,H元素与C、N、O形成化合物时,一般氢元素的化合价为正价,故电负性最小,故电负性的大小为O>N>C>H;
③上述配合物中C位于苯环上和亚甲基上,苯环上的碳原子价层电子对数为3对,采用的是sp2杂化,亚甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,
A.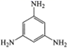 中苯环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故A不符合题意;
中苯环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故A不符合题意;
B.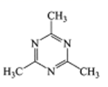 .中氮环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故B符合题意;
.中氮环上的碳原子碳原子价层电子对数为3对,采用的是sp2杂化,甲基上的碳原子价层电子对数为4对,亚甲基上的碳原子采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故B符合题意;
C.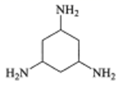 中环己烷上的碳原子价层电子对数诶4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故C不符合题意;
中环己烷上的碳原子价层电子对数诶4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故C不符合题意;
D. 中碳原子价层电子对数为4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故D不符合题意;
中碳原子价层电子对数为4对,均采用sp3杂化,N原子的价层电子对数为3对,杂化类型sp2杂化,故D不符合题意;
答案选B。
(3)根据图示,①![]() 中Co(NO2)6存在的化学键类型有极性共价键、配位键,亚硝酸钴钠可与K+形成离子键;
中Co(NO2)6存在的化学键类型有极性共价键、配位键,亚硝酸钴钠可与K+形成离子键;
②与亚硝酸根互为等电子体的化合物有SO2或SnO2;
(4)Co与Ca属于同一周期,且最外层电子数相同,但金属Co的熔点、沸点均比金属Ca的高,原因是Co原子半径小且价电子数多,金属键强;
(5) 根据CoTiO3晶胞中Co处于各顶角位置,根据Co原子的数目为1个,O原子的数目为3个,则O处于面心位置,由图可知与Co紧邻的O的个数为12个,若晶胞中Co与O的距离为anm,则晶胞的边长为![]() cm,阿伏加德罗常数的值为NA,该晶体的密度为
cm,阿伏加德罗常数的值为NA,该晶体的密度为![]()
,化简可得![]() 或
或![]() 或
或![]() 。
。
【点睛】
在计算密度时,需要利用数学计算,勾股定律计算出晶胞的半径,单位的换算是易错点。