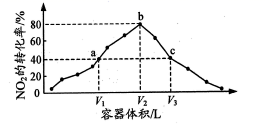
温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
答案
BD
【分析】
由反应![]() 可知容器体积越大,压强越小,反应往正方向移动,NO2的转化率提高,由图像可知,相同时间,a,b为已达到平衡点,c还未达到平衡,利用化学平衡常数和等效平衡进行分析。
可知容器体积越大,压强越小,反应往正方向移动,NO2的转化率提高,由图像可知,相同时间,a,b为已达到平衡点,c还未达到平衡,利用化学平衡常数和等效平衡进行分析。
【详解】
A. a点时反应达到平衡,NO2转化率为40%,则
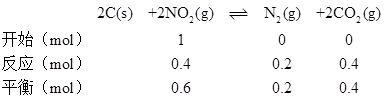
T℃时,该反应的化学平衡常数为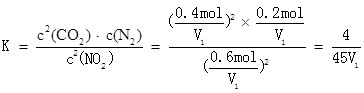 ,故A错误;
,故A错误;
B. 图中c点还未达到平衡,反应往正方向进行,v(正)>v(逆),故B正确;
C. 向a点平衡体系中充入一定量的NO2,等效于加压,平衡逆移,转化率降低,C错误;
D.由A可知a点时容器内气体物质的量为1.2mol;b点时反应三段式为
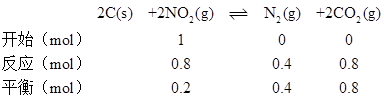
则b点容器内气体物质的量为1.4mol,由于V1<V2,则Pa:Pb>6:7,故D正确;
故答案选:BD。
【点睛】
计算化学平衡常数时是用浓度进行计算而不是物质的量进行计算。



 也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
也相同,但各物质的浓度、物质的量、混合气体的密度、体系的压强、气体的反应速率等均不相同但成比例。
