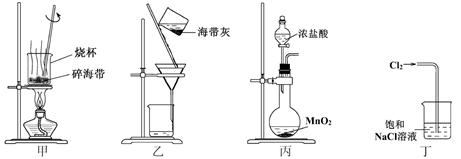
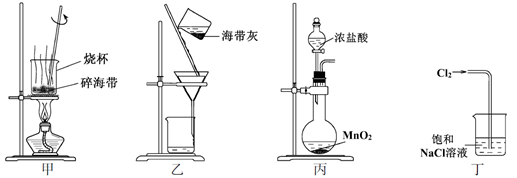
下列有关化学与自然资源的开发利用说法中不正确的是( )
A.海水提溴是将海水中的化合态的溴富集再转化为游离态的溴
B.石油裂化的主要目的是提高汽油的产量
C.煤干馏的产品很多,是一个化学変化
D.海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
答案
D
【解析】
A、根据工业上海水中提取溴的方法判断;
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质;
D、海水提镁的过程中从海水中得到氯化镁,再电解熔融的氯化镁得镁;
【详解】
A、海水中加入氧化剂,把溴离子氧化为溴单质,也就是先将海水中的化合态的溴富集再转化为游离态的溴,故A正确;
B、石油裂化的主要目的是将长的碳链断裂成短的碳链,得到汽油,以提高汽油的产量,故B正确;
C、煤干馏是将煤隔绝空气加强热,产生很多新物质(煤焦油、粗氨水、焦炉气等),所以是化学变化,故C正确;
D、海水提镁的过程中:把氢氧化镁与盐酸反应变为氯化镁,然后再电解熔融的氯化镁得到镁,故D错误;
正确选项D。