某研究小组用如图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。
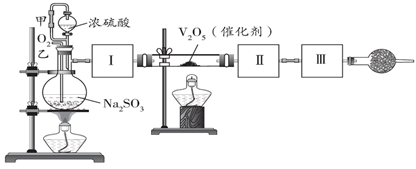
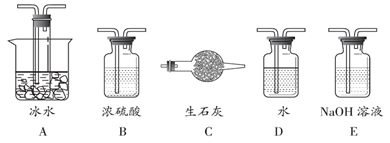
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ 处连接合适的装置。请从如图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ 处连接的装置分别是_______、_________、___________。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是________。
(3)实验中发现SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,分析可能的原因并说明相应的验证方法(写2点)。
①原因______,验证方法________。
②原因______,验证方法________。
(4)尾端球形干燥管的作用是________。
(5)用a mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了b g,则实验中SO2的转化率为______%(用含a、b的代数式表示)。
答案
B A E 先加热催化剂再加热浓硫酸 Na2SO3变质变成Na2SO4 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质 甲中用稀H2SO4代替浓H2SO4 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸 防止空气中的CO2及水蒸气干扰,造成误差 ![]()
【分析】
浓硫酸和亚硫酸钠反应生成二氧化硫,SO2转化成SO3之前必须用浓硫酸对二氧化硫进行干燥,二氧化硫在五氧化二钒的催化下转化成三氧化硫,生成的三氧化硫在A装置中以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,以此解答。
【详解】
(1)SO2转化成SO3之前必须对二氧化硫进行干燥,可以用浓硫酸,SO3的熔点是16.8℃,沸点是44.8℃,当温度低于 16.8℃时,三氧化硫以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,故答案为:B;A;E;
(2)为保证生成的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作,保证生成的二氧化硫尽可能的参与反应,故答案为:先加热催化剂再滴入浓硫酸;
(3)影响化学反应速率的因素有:浓度、温度等,亚硫酸钠变质会生成硫酸钠,硫酸钠和浓硫酸不反应;此外亚硫酸钠和稀硫酸反应产生的二氧化硫速率会很慢,可能的原因是Na2SO3变质或不是浓硫酸;可通过取待测试样于试管中,加适量的蒸馏水配成溶液,滴加足量的稀盐酸,再加入氯化钡溶液,如果有白色沉淀生成,则证明该亚硫酸钠已变质或者用洁净的玻璃棒沾取待测试样,滴到白纸上,如果不变黑,则证明该溶液不是浓硫酸,故答案为:Na2SO3变质成Na2SO4;取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质;甲中用稀H2SO4代替浓H2SO4;用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸;
(4)空气中的CO2及水蒸气会干扰实验,造成实验误差,需要通过尾接管中的生石灰除去,故答案为:防止空气中的CO2及水蒸气干扰,造成误差;
(5)根据元素守恒Na2SO3~SO2,则amol亚硫酸钠会生成二氧化硫amol,装置Ⅲ增重了bg,说明剩余的二氧化硫为bg(即![]() =
=![]() mol),所以二氧化硫的转化率=
mol),所以二氧化硫的转化率=![]() ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %。
%。



 B
B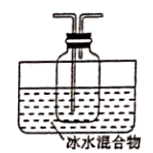
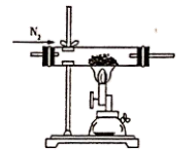 D
D