FFC电解法可由金属氧化物直接电解制备金属单质,西北稀有金属材料研究院利用此法成功电解制备钽粉(Ta),其原理如图所示。下列说法正确的是
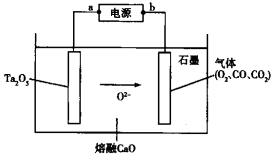
A.该装置将化学能转化为电能
B.a极为电源的正极
C.Ta2O5极发生的电极反应为Ta2O5+10e—=2Ta+5O2—
D.石墨电极上生成22.4 L O2,则电路中转移的电子数为4×6.02×1023
答案
C
【分析】
电解池工作时O2-向阳极移动,则石墨电极为阳极,电源的b极为正极,电解池的阴极发生还原反应,据此分析解题。
【详解】
A.该装置是电解池,是将电能转化为化学能,故A错误;B.电解池工作时O2-向阳极移动,则石墨电极为阳极,电源的b极为正极,a极为电源的负极,故B错误;C.Ta2O5极为阴极,发生还原反应,其电极反应为Ta2O5+10e—=2Ta+5O2—,故C正确;D.石墨电极上生成的22.4 L O2没有指明是标准状况,则其物质的量不一定是1mol,转移电子数也不一定是4×6.02×1023,故D错误;故答案为C。
【点睛】
本题考查电解原理的应用,判断电源的电极是解题关键,在电解池中,阴离子移向阳极,阳离子移向阴极,再结合电解池的阴极发生还原反应,阳极发生氧化反应分析,难点是气体摩尔体积的应用,只有指明气体的状态,才能利用22.4L/mol计算气体的物质的量。