NA代表阿伏加德罗常数的值,下列叙述错误的是
①18 g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移电子数为 NA
③常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1 L 0.50 mol·L━1NH4Cl溶液与2 L 0.25mol·L━1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A.② B.②④⑤ C.④⑤ D.②④
C
【解析】
①,n(C)=![]() =1.5mol,金刚石属于原子晶体,其中n(C):n(C-C)=1:2,则含有的碳碳共价键为3mol,①正确;②,Cu与S反应生成Cu2S,Cu元素的化合价由0价升至+1价,1molCu完全反应转移1mol电子,②正确;③,S2和S8的混合物中只有S元素,n(S)=
=1.5mol,金刚石属于原子晶体,其中n(C):n(C-C)=1:2,则含有的碳碳共价键为3mol,①正确;②,Cu与S反应生成Cu2S,Cu元素的化合价由0价升至+1价,1molCu完全反应转移1mol电子,②正确;③,S2和S8的混合物中只有S元素,n(S)=![]() =0.2mol,③正确;④,由于NH4+的水解,两溶液中NH4+物质的量都小于0.5mol,NH4Cl的浓度越小,NH4+的水解程度越大,后者NH4+更少,④错误;⑤,电解精炼铜,阳极为粗铜,阳极电极反应为Zn-2e-=Zn2+、Fe-2e-=Fe2+、Cu-2e-=Cu2+,粗铜中活泼性不如Cu的杂质以阳极泥的形式沉降,由于阳极中各杂质的比例未知,无法计算电路中通过的电子物质的量,⑤错误;错误的为④⑤,答案选C。
=0.2mol,③正确;④,由于NH4+的水解,两溶液中NH4+物质的量都小于0.5mol,NH4Cl的浓度越小,NH4+的水解程度越大,后者NH4+更少,④错误;⑤,电解精炼铜,阳极为粗铜,阳极电极反应为Zn-2e-=Zn2+、Fe-2e-=Fe2+、Cu-2e-=Cu2+,粗铜中活泼性不如Cu的杂质以阳极泥的形式沉降,由于阳极中各杂质的比例未知,无法计算电路中通过的电子物质的量,⑤错误;错误的为④⑤,答案选C。
点睛:本题考查以阿伏加德罗常数为载体的计算,涉及物质组成微粒和化学键的判断、盐类水解、电解精炼铜、氧化还原反应中转移电子数的确定。需要注意:(1)金刚石中每个碳原子形成4个C-C键,金刚石中n(C):n(C-C)=1:2;(2)S的氧化性较弱只能将Cu氧化成+1价;(3)浓度对盐类水解平衡的影响,规律为越稀越水解;(4)电解精炼铜时阳极不是只有Cu放电。
![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.![]() ,
,![]() 完全反应转移的电子数为
完全反应转移的电子数为![]()
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为![]() 时,阳极应有
时,阳极应有![]() 转化为
转化为![]()
C.常温下,![]() 的
的![]() 溶液中,水电离出的
溶液中,水电离出的![]() 数为
数为![]()
D.![]() 浓度为
浓度为![]() 的
的![]() 溶液中,阴离子数为
溶液中,阴离子数为![]()
A
【详解】
A. Mn元素的化合价由+7价降至+2价,则4mol![]() 完全反应转移电子物质的量为4mol×[(+7)-(+2)]=20mol,即转移电子数为20NA,A正确;
完全反应转移电子物质的量为4mol×[(+7)-(+2)]=20mol,即转移电子数为20NA,A正确;
B.电解精炼铜时,阳极为粗铜,阳极发生的电极反应有:比铜活泼的杂质金属失电子发生氧化反应以及Cu失电子的氧化反应:Cu-2e-=Cu2+,当电路中通过的电子数为NA时,即电路中通过1mol电子,Cu失去的电子应小于1mol,阳极反应的Cu的物质的量小于0.5mol,则阳极反应的Cu的质量小于0.5mol×64g/mol=32g,B错误;
C.溶液的体积未知,不能求出溶液中水电离出的H+数,C错误;
D.n(Na2CO3)=0.100mol/L×1L=0.100mol,由于![]() 发生水解:
发生水解:![]() +H2O⇌
+H2O⇌![]() +OH-、
+OH-、![]() +H2O⇌H2CO3+OH-,故阴离子物质的量大于0.100mol,阴离子数大于0.100NA,D错误;
+H2O⇌H2CO3+OH-,故阴离子物质的量大于0.100mol,阴离子数大于0.100NA,D错误;
答案选A。
下列有关电化学原理及应用的相关说法正确的是
A.电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能
B.电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒
C.工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同
D.电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极
D
【详解】
A.电池是能量高效转化装置,但是燃料电池放电的时候化学能并不能完全转化为电能,如电池工作时,在电路中会产生热能,A项错误;
B.牺牲阳极的阴极保护法需要外接活泼金属,Cu的活动性比Fe的活动性低,因此起不到保护的作用,B项错误;
C.电解精炼铜的过程中,阳极除了Cu,还有Zn、Fe等比Cu活泼的金属也会失去电子,阴极始终是Cu2+被还原成Cu,所以阳极质量的减少和阴极质量的增加不相同,C项错误;
D.利用电解法使铝的表面生成氧化铝,Al的化合价从0升高到+3,失去电子,在电解池中作阳极,D项正确;
本题答案选D。
有关下列四个常用电化学装置的叙述中,正确的是
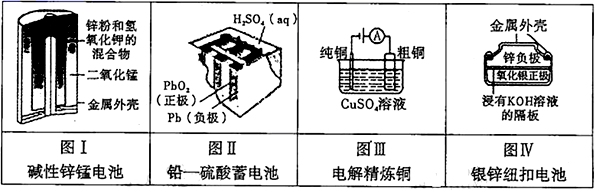
A.图Ⅰ所示电池中,MnO2是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池工作过程中,电子由Zn极流向Ag2O极
D
【解析】分析:A项,碱性锌锰电池中,MnO2为正极;B项,铅-硫酸蓄电池放电过程中的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,硫酸浓度不断减小;C项,电解精炼铜的过程中,电解质溶液中Cu2+浓度开始一段时间减小;D项,银锌纽扣电池中,Zn为负极,Ag2O为正极,电池工作过程中电子由Zn极流向Ag2O极。
详解:A项,碱性锌锰电池中,MnO2为正极,正极电极反应式为MnO2+e-+H2O=MnO(OH)+OH-,A项错误;B项,铅-硫酸蓄电池放电过程中的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,硫酸被消耗同时生成H2O,硫酸浓度不断减小,B项错误;C项,电解精炼铜时粗铜为阳极,纯铜为阴极,电解精炼铜的过程中,阳极先是粗铜中比Cu活泼的金属放电,后是Cu放电,阴极始终是Cu2++2e-=Cu,电解质溶液中Cu2+浓度开始一段时间减小,C项错误;D项,银锌纽扣电池中,Zn为负极,Ag2O为正极,电池工作过程中电子由Zn极流向Ag2O极,D项正确;答案选D。
普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是
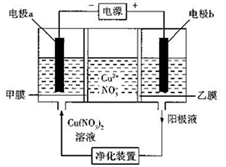
A.电极a为粗铜,电极b为精铜
B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D.当电路中通过1mol电子时,可生成32g精铜
D
【解析】
A. 由题意结合电解原理可知,电极a是阴极,为精铜;电极b阳极,为粗铜,A不正确;B. 甲膜为阴离子交换膜,可阻止杂质离子阳离子进入阴极区,B不正确;C. 乙膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区,C不正确;D. 当电路中通过1mol电子时,可生成0.5mol精铜,其质量为32g ,D正确。本题选D。
本卷还有95题,登录并加入会员即可免费使用哦~

该作品由: 用户hushuiqing分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。