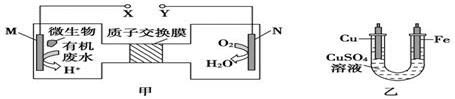
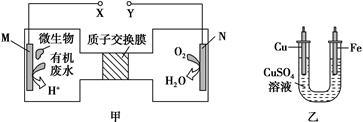
如图甲是一种利用微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
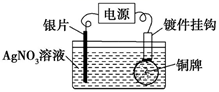
A.乙装置中溶液颜色会变浅
B.铁电极应与 Y 相连接
C.M 电极反应式:H2NCONH2+H2O-6e-===CO2↑+N2↑+6H+
D.当 N 电极消耗 0.25 mol 气体时,铜电极质量减少 16 g
答案
C
【分析】
由图甲O2生成H2O,可知N为正极,M为负极;图乙为电镀装置,铁作阴极,与电源负极相连,据此答题。
【详解】
A.乙装置为电镀装置,电镀液的浓度不变,因此溶液的颜色不变,故A错误;
B.电镀时,待镀金属作阴极,与电源负极相连,而N电极上O2转化为H2O,发生还原反应,N电极为正极,故B错误;
C.尿素失电子生成CO2和N2,碳元素化合价没有变化,1 mol尿素失去6mol电子,所以M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2↑+6H+,故C正确;
D.根据N电极反应式:O2+4H++4e-=2H2O,铜电极反应式:Cu-2e-=Cu2+,由各电极上转移的电子数相等,可得关系式:O2~2Cu,则N电极消耗0.25mol氧气时,铜电极质量减少0.25mol×2×64g/mol=32g,故D错误。
故选C。