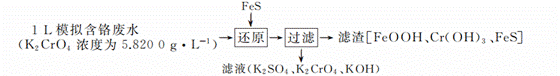
以绿矾(FeSO4·7H2O)为原料制备高铁酸钾(K2FeO4)的流程如下:

(1) “氧化”时发生反应的离子方程式为_____。
(2) “合成”时生成Na2FeO4的离子方程式为______。
不同温度和pH下![]() 在水溶液中的稳定性如下图所示。
在水溶液中的稳定性如下图所示。

为了提高“合成”时Na2FeO4的产率,下列措施可行的是________(填字母)。
A.充分搅拌反应液
B.控制反应在60 ℃左右进行
C.将氧化后所得溶液分多次加入NaClO和NaOH混合溶液中
D.将NaClO和NaOH混合溶液分多次加入氧化后所得溶液中
(3) “滤渣”的主要成分为______(填化学式)。
(4) 向“过滤”后的滤液中加入饱和KOH溶液可析出K2FeO4晶体,说明该温度下两者饱和溶液的物质的量浓度c(K2FeO4)______c(Na2FeO4)(填“<”、“>”或“=”);此时母液中的阴离子除![]() 和OH-外,一定还含有____。
和OH-外,一定还含有____。
答案
2Fe2++H2O2+2H+===2Fe3++2H2O 3ClO-+10OH-+2Fe3+===2![]() +3Cl-+5H2O AC Fe(OH)3 <
+3Cl-+5H2O AC Fe(OH)3 < ![]() 、Cl-
、Cl-
【分析】
过氧化氢在酸性条件下将亚铁离子氧化为铁离子,通过条件反应温度、把将氧化后所得溶液分多次加入NaClO和NaOH混合溶液中,碱性环境中ClO-把Fe3+氧化物![]() ,过滤除去少量氢氧化铁沉淀,往滤液中加入饱和氢氧化钾溶液,即可提取高铁酸钾晶体;
,过滤除去少量氢氧化铁沉淀,往滤液中加入饱和氢氧化钾溶液,即可提取高铁酸钾晶体;
【详解】
(1) 绿矾溶解产生亚铁离子,过氧化氢在酸性条件下将亚铁离子氧化为铁离子,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O ;
(2) 根据流程可知,“合成”时生成Na2FeO4的离子方程式为3ClO-+10OH-+2Fe3+===2![]() +3Cl-+5H2O;四个措施讨论如下:A.充分搅拌反应液,可使反应充分,可提高Na2FeO4的产率,故A正确;B.由图可知控制反应在60℃左右进行,高铁酸钠的产率较低,故B错误;C.从示意图知,碱性条件下高铁酸根离子产率高,故将氧化后所得溶液分多次加入NaClO和NaOH混合溶液中可提高Na2FeO4的产率,故C正确;D.将NaClO和NaOH混合溶液分多次加入氧化后所得溶液中不能提高Na2FeO4的产率,故D错误;故答案为AC;
+3Cl-+5H2O;四个措施讨论如下:A.充分搅拌反应液,可使反应充分,可提高Na2FeO4的产率,故A正确;B.由图可知控制反应在60℃左右进行,高铁酸钠的产率较低,故B错误;C.从示意图知,碱性条件下高铁酸根离子产率高,故将氧化后所得溶液分多次加入NaClO和NaOH混合溶液中可提高Na2FeO4的产率,故C正确;D.将NaClO和NaOH混合溶液分多次加入氧化后所得溶液中不能提高Na2FeO4的产率,故D错误;故答案为AC;
(3)在合成时会有部分铁离子转化为氢氧化铁,则“滤渣”的主要成分为Fe(OH)3;
(4)向"过滤"后的滤液中加入饱和KOH溶液可析出K2FeO4晶体,根据物质的溶解性可知该温度下两者饱和溶液的物质的量浓度c(K2FeO4) < c(Na2FeO4);根据元素守恒可知此时母液中的阴离子除![]() 和OH-外,一定还含有
和OH-外,一定还含有![]() 、Cl-。
、Cl-。