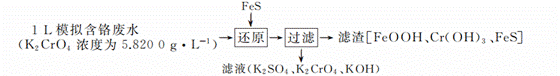
实验室用 H 2 还原 WO3 制备金属 W 的装置如下图所示(Zn 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法错误的是
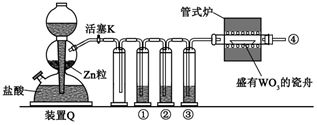
A.反应开始时,先加热管式炉,再打开活塞 K
B.往盐酸中加入少量 CuCl2,可加快产生 H2 的速率
C.①、②、③中依次盛装 KMnO4 溶液、焦性没食子酸溶液、浓 H2SO4
D.装置 Q(启普发生器)也可用于石灰石与盐酸反应制二氧化碳
答案
A
【解析】
A项,反应开始时,应先打开活塞K用产生的氢气排出装置中的空气,待氢气验纯后,再加热管式炉,故A错误;
B项,往盐酸中加入少量 CuCl2,锌置换出铜,形成原电池,可加快产生H2的速率,故B项正确;
C项,①、②、③中依次盛装 KMnO4 溶液、焦性没食子酸溶液、浓 H2SO4,能达到除杂干燥目的,故C项正确;
D项,石灰石与盐酸反应制二氧化碳,是块状固体和液体反应制取气体且不需要加热,故可用启普发生器,故D项正确。
故答案选A。