用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O。
2Cl2+2H2O。
(1)已知:Ⅰ反应A中, 1 mol HCl被氧化,放出28.9 kJ的热量。
Ⅱ![]()
①反应A的热化学方程式是___________________________。
②断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为____kJ。
(2)对于反应A,下图是4种投料比[n(HCl)∶n(O2)分别为1∶1、2∶1、4∶1和6∶1]下,反应温度对HCl平衡转化率影响的曲线。
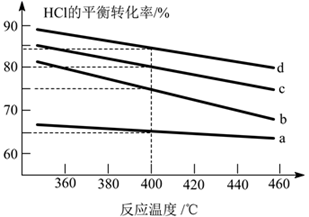
① 曲线b对应的投料比是__________。
② 当曲线b,c,d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度Tb、Tc、Td由大到小的顺序是___________________。
③ 投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______。
答案
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 4:1 31.9 Td>Tc>Tb 30.8%
【详解】
(1)①由反应A中,1mol HCl被氧化,放出28.9kJ的热量可知,4mol HCl被氧化放出热量为28.9kJ×4= 115.6 kJ,则反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,故答案为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1;
②1 mol H—O与1molH—Cl的键能分别是设为x和y,由反应热=反应物键能之和—生成物键能之和可得:(4x+498kJ/mol)-(2×243kJ/mol+2×2y)=-115.6kJ/mol,解得x-y=31.9kJ/mol,故答案为:31.9;
(2)①反应中,氧气的物质的量越多,氯化氢的转化率越高,即n(HCl):n(O2)的比值越小,氯化氢的转化率越高,由图可知,投料比分别为1:1、2:1、4:1、6:1时氯化氢的转化率一次降低,则曲线b对应的投料比是4:1,故答案为:4:1;
②由图可知,当曲线b,c,d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度Tb、Tc、Td由大到小的顺序是Td>Tc>Tb,故答案为:Td>Tc>Tb;
③根据曲线可知投料比为2:1、温度为400℃时,氯化氢的平衡转化率是80%,由题给数据建立如下三段式:

由三段式数据可知,平衡混合气中Cl2的物质的量分数是![]() ×100%=30.8%,故答案为:30.8%。
×100%=30.8%,故答案为:30.8%。