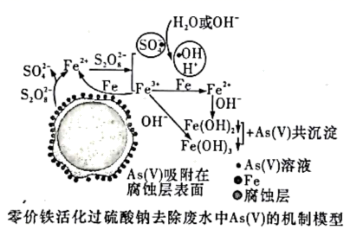
研究表明,氮氧化物和二氧化硫等气体与雾霾的形成有关(如图所示)。

(1)过程①中NOx(x=1或2)发生_______(填“氧化”或“还原”)反应。
(2)气体A的化学式是________。
(3)过程②的化学方程式是________。
(4)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H1= -a kJ/mol
S(s)+O2(g)=SO2(g) △H2= -b kJ/mol
家庭常用燃料液化石油气中含有微量H2S,在燃烧过程中会产生SO2。该反应的热化学方程式是____________。
答案
氧化 NH3 2SO2+O2![]() 2SO3 2H2S(g)+3O2(g) == 2SO2(g)+2H2O(l) △H= -(a+2b) kJ/mol
2SO3 2H2S(g)+3O2(g) == 2SO2(g)+2H2O(l) △H= -(a+2b) kJ/mol
【分析】
由图可知:燃料产生的氮氧化物转化成最高价氮的氧化物,并和水反应生成硝酸,进一步与NH3生成铵盐;产生的二氧化硫转化成最高价硫的氧化物SO3,并与水形成硫酸,进一步与氨气生成硫酸铵;两种铵盐和燃料燃烧产生的颗粒物形成雾霾。在此认识基础上对本题做出解答。
【详解】
(1)NO或NO2生成N2O5,N化合价升高,被氧化,发生氧化反应,故答案为:氧化
(2)与HNO3或H2SO4反应生成相应铵盐的气体是NH3,故答案为:NH3
(3)SO2生成SO3需要在催化剂作用下发生:2SO2+O2![]() 2SO3,故答案为:2SO2+O2
2SO3,故答案为:2SO2+O2![]() 2SO3
2SO3
(4)由反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) ①S(s)+O2(g)=SO2(g)②,由盖斯定律可知①+2×②得到H2S燃烧生成SO2的反应:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l) △H,故△H=△H1+2△H2=-(a+2b) kJ/mol,则该反应的热化学方程式为:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l) △H =-(a+2b) kJ/mol,故答案为:2H2S(g)+3O2(g) = 2SO2(g) + 2H2O(l) △H =-(a+2b) kJ/mol
【点睛】
焓变随热化学方程式变化的运算规则为:方程乘以某数,则焓变也乘以该数;方程相加减,则焓变也相加减。