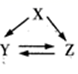下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
| 选项 | X | Y | Z |
|
| A | Si | Na2SiO3 | H2SiO3 | |
| B | S | H2S | SO2 | |
| C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
| D | Mg(OH)2 | MgCO3 | MgCl2 |
A.A B.B C.C D.D
答案
C
【详解】
A、Si无法直接转化为H2SiO3, 选项A错误;
B、SO2无法直接转化为H2S, 选项B错误;
C、Al2O3 与NaOH溶液反应生成NaAlO2、与硫酸反应生成Al2(SO4)3,NaAlO2 与硫酸反应得到Al2(SO4)3, Al2(SO4)3 与足量NaOH溶液反应得到NaAlO2,选项C正确;
D、Mg(OH)2无法直接转化为MgCO3,选项D错误。
答案选C。
【点睛】
本题考查了物质之间的转化,明确物质的性质、熟悉发生的化学反应是解题关键,侧重对学生基础知识的检验和训练,易错点为选项B.AlCl3与过量氢氧化钠反应生成NaAlO2,NaAlO2与弱酸反应生成Al(OH)3,与硫酸反应得到Al2(SO4)3。