CH4与CO2重整生成H2和CO的过程中主要发生下列反应![]()
![]()
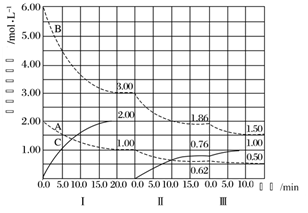
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是
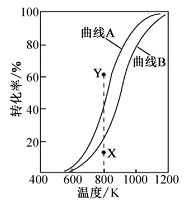
A.曲线A表示CH4的平衡转化率随温度的变化
B.反应: 3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)△H =+329.5kJ•mol—1
C.升高温度、减小压强均有利于提高CH4的平衡转化率
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,可通过改变CO2的量或使用高效催化剂等特定条件继续反应,CH4转化率能达到Y点的值
答案
AD
【解析】
A.由题给方程式可知,甲烷只参与一个反应,而二氧化碳参与两个反应,反应中二氧化碳的消耗量一定大于甲烷的消耗量,相同条件下二氧化碳的转化率一定大于甲烷的转化率,则曲线B表示CH4的平衡转化率随温度的变化,故A错误;
B.将已知反应依次编号为①②,由盖斯定律可知,①+②×2得反应3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)则△H =(+247.1kJ•mol—1)+(+41.2329.5kJ•mol—1)=+329.5kJ•mol—1,反应的热化学方程式为3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)△H =+329.5kJ•mol—1,故B正确;
C.甲烷和二氧化碳的反应是一个气体体积增大的吸热反应,升高温度和减小压强,平衡均向正反应方向移动,有利于提高CH4的平衡转化率,故C正确;
D.使用高效催化剂,化学平衡不移动,CH4转化率不会改变,故D错误;
故选AD。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。