2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
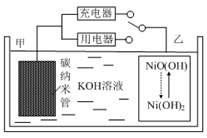
A.放电时,乙电极反应为:NiO(OH)+H2O-e﹣=Ni(OH)2+OH﹣
B.放电时,甲电极为负极,该电极区溶液的pH逐渐减小
C.充电时,电池的碳电极与直流电源的正极相连,电极反应为: 2H2O+2e﹣= H2↑+2OH﹣
D.电池总反应为H2+2NiOOH ![]() 2Ni(OH)2
2Ni(OH)2
BD
【解析】
开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答。
【详解】
A. 放电时,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-,故A错误;
B. 放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH−向负极甲电极移动,负极发生H2+2OH--2e-═2H2O,所以氢氧根浓度降低,pH逐渐减小,故B正确;
C. 放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故C错误;
D. 放电时,正极电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,负极电极反应式为:H2+2OH--2e-═2H2O,则两式相加得总反应:H2+2NiOOH ![]() 2Ni(OH)2,故D正确;
2Ni(OH)2,故D正确;
故选:BD。
次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3 N2H4+NaCl+H2O。下列表示相关微粒的化学用语正确的是
N2H4+NaCl+H2O。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子:![]() B.H2O的电子式:
B.H2O的电子式:![]()
C.Cl-的结构示意图: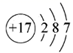 D.N2H4的结构式:
D.N2H4的结构式: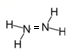
B
【解析】
A.中子数为9的氮原子的质量数是7+9 =16,原子符号可表示为:![]() N ,故A错误;
N ,故A错误;
B.H2O是含有共价键的共价化合物,电子式为:![]() ,故B正确;
,故B正确;
C.Cl-的质子数是17,其结构示意图为: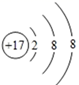 ,故C 错误;
,故C 错误;
D.N2H4的电子式为![]() ,其结构式:
,其结构式: ,故D错误;
,故D错误;
故选B。
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(![]() )+c(H2CO3)+c(
)+c(H2CO3)+c(![]() )
)
D.0.2 mol∙L−1CH3COOH溶液与0.1 mol∙L−1 NaOH溶液等体积混合(pH<7):c(H+)+c(CH3COOH)<c(CH3COO-)+c(OH-)
CD
【解析】
A.新制氯水中加入固体NaOH,根据电荷守恒得到:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.pH=8.3的NaHCO3溶液,说明![]() 水解程度大于电离程度,溶液显碱性,浓度大小为:c(Na+)>c(
水解程度大于电离程度,溶液显碱性,浓度大小为:c(Na+)>c(![]() )>c(H2CO3)>c(
)>c(H2CO3)>c(![]() ),故B错误;
),故B错误;
C.等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒即氯元素和碳元素相等得到,c(HClO)+c(ClO-)=c(![]() )+c(H2CO3)+c(
)+c(H2CO3)+c(![]() ),故C正确;
),故C正确;
D.0.2 mol∙L−1 CH3COOH溶液与0.1 mol∙L−1 NaOH溶液等体积混合(pH<7),溶液中溶质为CH3COOH、CH3COONa,两者浓度相等,根据电荷守恒得到c(H+)+c(Na+)=c(CH3COO-)+c(OH-),由于溶液显酸性,说明醋酸电离程度占主要即c(CH3COOH)<c(Na+),因此c(H+)+c(CH3COOH)<c(CH3COO-)+c(OH-),故D正确。
综上所述,答案为CD。
CH4与CO2重整生成H2和CO的过程中主要发生下列反应![]()
![]()
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法不正确的是
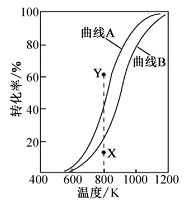
A.曲线A表示CH4的平衡转化率随温度的变化
B.反应: 3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)△H =+329.5kJ•mol—1
C.升高温度、减小压强均有利于提高CH4的平衡转化率
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,可通过改变CO2的量或使用高效催化剂等特定条件继续反应,CH4转化率能达到Y点的值
AD
【解析】
A.由题给方程式可知,甲烷只参与一个反应,而二氧化碳参与两个反应,反应中二氧化碳的消耗量一定大于甲烷的消耗量,相同条件下二氧化碳的转化率一定大于甲烷的转化率,则曲线B表示CH4的平衡转化率随温度的变化,故A错误;
B.将已知反应依次编号为①②,由盖斯定律可知,①+②×2得反应3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)则△H =(+247.1kJ•mol—1)+(+41.2329.5kJ•mol—1)=+329.5kJ•mol—1,反应的热化学方程式为3CO2(g)+ CH4(g)=2 H2O(g)+4CO(g)△H =+329.5kJ•mol—1,故B正确;
C.甲烷和二氧化碳的反应是一个气体体积增大的吸热反应,升高温度和减小压强,平衡均向正反应方向移动,有利于提高CH4的平衡转化率,故C正确;
D.使用高效催化剂,化学平衡不移动,CH4转化率不会改变,故D错误;
故选AD。
下列有关说法正确的是
A.在外加电流的阴极保护法中,海上石油钢铁钻井平台与直流电源的负极相连
B.常温下,BaSO4分别在同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同
C.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度
D.对于N2(g)+3H2(g) ![]() 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率减小,平衡正向移动
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率减小,平衡正向移动
A
【解析】
A.在外加电流的阴极保护法中,钢铁钻井平台与直流电源的负极相连,阴极受到保护,故A正确;
B.常温下,同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液,硫酸铝中硫酸根浓度比硫酸钠中硫酸根浓度大,根据溶解度公式得到硫酸铝溶液中钡离子浓度小,因此BaSO4在Al2(SO4)3中溶解度小,故B错误;
C.锌与稀硫酸反应时加入少量硫酸铜,主要是Cu2+被锌还原为Cu,形成锌铜稀硫酸原电池,加快反应速率,故C错误;
D.对于N2(g)+3H2(g) ![]() 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率增大,平衡向体积减小的反应移动即正向移动,故D错误。
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率增大,平衡向体积减小的反应移动即正向移动,故D错误。
综上所述,答案为A。
本卷还有15题,登录并加入会员即可免费使用哦~

该作品由: 用户李宇杰分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。