常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(![]() )+c(H2CO3)+c(
)+c(H2CO3)+c(![]() )
)
D.0.2 mol∙L−1CH3COOH溶液与0.1 mol∙L−1 NaOH溶液等体积混合(pH<7):c(H+)+c(CH3COOH)<c(CH3COO-)+c(OH-)
答案
CD
【解析】
A.新制氯水中加入固体NaOH,根据电荷守恒得到:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.pH=8.3的NaHCO3溶液,说明![]() 水解程度大于电离程度,溶液显碱性,浓度大小为:c(Na+)>c(
水解程度大于电离程度,溶液显碱性,浓度大小为:c(Na+)>c(![]() )>c(H2CO3)>c(
)>c(H2CO3)>c(![]() ),故B错误;
),故B错误;
C.等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒即氯元素和碳元素相等得到,c(HClO)+c(ClO-)=c(![]() )+c(H2CO3)+c(
)+c(H2CO3)+c(![]() ),故C正确;
),故C正确;
D.0.2 mol∙L−1 CH3COOH溶液与0.1 mol∙L−1 NaOH溶液等体积混合(pH<7),溶液中溶质为CH3COOH、CH3COONa,两者浓度相等,根据电荷守恒得到c(H+)+c(Na+)=c(CH3COO-)+c(OH-),由于溶液显酸性,说明醋酸电离程度占主要即c(CH3COOH)<c(Na+),因此c(H+)+c(CH3COOH)<c(CH3COO-)+c(OH-),故D正确。
综上所述,答案为CD。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

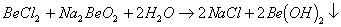 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 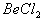 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO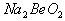 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO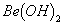 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液