2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
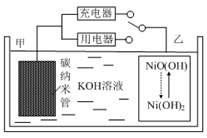
A.放电时,乙电极反应为:NiO(OH)+H2O-e﹣=Ni(OH)2+OH﹣
B.放电时,甲电极为负极,该电极区溶液的pH逐渐减小
C.充电时,电池的碳电极与直流电源的正极相连,电极反应为: 2H2O+2e﹣= H2↑+2OH﹣
D.电池总反应为H2+2NiOOH ![]() 2Ni(OH)2
2Ni(OH)2
答案
BD
【解析】
开关连接用电器时,应为原电池原理,甲电极为负极,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;开关连接充电器时,为电解池,充电与放电过程相反,据此解答。
【详解】
A. 放电时,乙电极为正极得电子发生还原反应,电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH-,故A错误;
B. 放电时,该电池为原电池,电解质溶液中阴离子向负极移动,所以OH−向负极甲电极移动,负极发生H2+2OH--2e-═2H2O,所以氢氧根浓度降低,pH逐渐减小,故B正确;
C. 放电时,氢气在碳电极发生氧化反应,碳电极作负极,充电时,碳电极发生还原反应作阴极,应与电源的负极相连,故C错误;
D. 放电时,正极电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,负极电极反应式为:H2+2OH--2e-═2H2O,则两式相加得总反应:H2+2NiOOH ![]() 2Ni(OH)2,故D正确;
2Ni(OH)2,故D正确;
故选:BD。



 B
B
 D
D