硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:
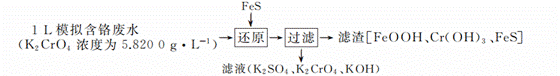
(1)“还原”过程发生反应的离子方程式为______。
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.210 0 g。将上述2.210 0 g固体在空气中加热,测得固体质量随温度的变化如图所示。
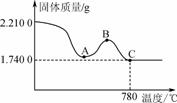
说明:(Ⅰ)780℃以上的残留固体为Fe2O3、Cr2O3的混合物。
(Ⅱ)有关物质的摩尔质量如下表:
| 物质 | K2CrO4 | Cr(OH)3 | Cr2O3 | FeS | FeOOH | Fe2O3 |
| M/(g·mol-1) | 194 | 103 | 152 | 88 | 89 | 160 |
①A→B固体质量增加是由滤渣中_____(填化学式)发生反应引起的。
②根据以上实验数据计算上述模拟废水中铬元素的去除率(写出计算过程)。____________
答案
FeS+3CrO42-+7H2O===FeOOH+3Cr(OH)3+SO42-+4OH- FeS 1L模拟废水中含n(K2CrO4)=![]() =3.000×10-2mol
=3.000×10-2mol
设2.2100g固体中含有x mol FeS、y mol FeOOH
则2.2100g固体中Cr(OH)3为3y mol,灼烧所得的1.740 0 g固体中Fe2O3为![]() mol,
mol,
Cr2O3为1.5y mol
x mol×88 g·mol-1+y mol×89 g·mol-1+3y mol×103 g·mol-1=2.210 0 g
![]() mol×160 g·mol-1+1.5y mol×152 g·mol-1=1.740 0 g
mol×160 g·mol-1+1.5y mol×152 g·mol-1=1.740 0 g
n[Cr(OH)3]=3y=1.500×10-2 mol
废水中+6价Cr的去除率=![]() ×100%=50%
×100%=50%
【解析】
(1)根据流程“还原”过程反应物为K2CrO4、FeS,生成物为Cr(OH)3、K2SO4、FeOOH,反应的方程式为:FeS+3CrO42-+7H2O===FeOOH+3Cr(OH)3+SO42-+4OH-;
(2)①A→B固体质量增加,开始FeS加热时生成铁单质,质量减小,继续升温则铁生成氧化铁,质量增加,则引起质量增加的由FeS引起的;
②已知1L模拟废水中含K2CrO4的质量为5.8200g/L,则n(K2CrO4)=![]() =3.000×10-2mol,根据方程式Cr(OH)3是FeOOH的3倍,设设2.2100g固体中含有x mol FeS、y mol FeOOH,则n(Cr(OH)3)=3y,灼烧所得的1.740 0 g固体中Fe2O3为
=3.000×10-2mol,根据方程式Cr(OH)3是FeOOH的3倍,设设2.2100g固体中含有x mol FeS、y mol FeOOH,则n(Cr(OH)3)=3y,灼烧所得的1.740 0 g固体中Fe2O3为![]() mol,Cr2O3为1.5y mol,列方程组x mol×88 g·mol-1+y mol×89 g·mol-1+3y mol×103 g·mol-1=2.210 0 g;
mol,Cr2O3为1.5y mol,列方程组x mol×88 g·mol-1+y mol×89 g·mol-1+3y mol×103 g·mol-1=2.210 0 g;![]() mol×160 g·mol-1+1.5y mol×152 g·mol-1=1.740 0 g;化简求得n[Cr(OH)3]=1.500×10-2 mol,铬元素的去除率=1.500×10-2 mol/3.000×10-2mol=50%;
mol×160 g·mol-1+1.5y mol×152 g·mol-1=1.740 0 g;化简求得n[Cr(OH)3]=1.500×10-2 mol,铬元素的去除率=1.500×10-2 mol/3.000×10-2mol=50%;