如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题。
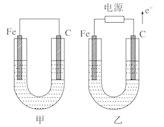
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的___________棒,乙池中的________棒。
②乙池中阳极的电极反应式是:_________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:____________________。
②甲池中碳极的电极反应式是:______________,乙池中碳极的电极反应属于_______(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池中碳极附近,发现试纸变蓝,过一段时间后又发现蓝色褪去,这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:__________________。
答案
(1). 碳 (2). 铁 (3). 4OH--4e-=2H2O+O2↑ (4). 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- (5). 2H2O+O2+4e-=4OH- (6). 氧化反应 (7). 5Cl2+I2+6H2O=2HIO3+10HCl
Cl2↑+H2↑+2OH- (5). 2H2O+O2+4e-=4OH- (6). 氧化反应 (7). 5Cl2+I2+6H2O=2HIO3+10HCl
【解析】(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑。
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,乙池中总反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,2H2O+O2+4e-=4OH-,乙装置中,碳棒是阳极,发生失电子的氧化反应;
③根据题意知Cl2将生成的I2氧化,若反应的Cl2和I2物质的量之比为5∶1,则生成盐酸和碘酸两种酸,利用化合价升降法配平,该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl。
