已知水在25℃和95℃时,水电离平衡曲线如图所示:

(1)则95℃时,水的电离平衡曲线应为B,请说明理由______________________.
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是______________.
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______________α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________________。
(1). 水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)大 (2). 10∶1 (3). a+b=14 (4). 小于 (5). 10
【解析】(1)水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)均增大,95℃时,水的电离平衡曲线应为B;25℃时, pH=9的NaOH溶液,c(OH-)=10-5mol/L;pH=4的H2SO4溶液中,c(H+)=10-4mol/L;若二者所得混合溶液的pH=7,n(OH-)=n(H+)。则c(OH-)∙V(NaOH)= c(H+)∙V(H2SO4)。故NaOH溶液与H2SO4溶液的体积比为V(NaOH)∶V(H2SO4)= c(H+)∶c(OH-)=10∶1;
(2)95℃时,水的离子积常数是Kw=10-12。若100体积pH=a的某强酸溶液中n(H+)=100×10-amol=10(2-a)mol,1体积pH=b的某强碱溶液n(OH-)=10-12÷10-b=10(b-12)mol,混合后溶液呈中性,10(2-a)mol=10(b-12)mol,2-a=b-12,所以a+b=14;
(3)曲线A所对应的温度是室温。在室温下,pH=2的HCl溶液,c(H+)水=10-12mol/L;pH=11的某BOH溶液中,c(H+)水=10-11mol/L;水电离产生的H+的浓度越大,水的电离程度就越大,若水的电离程度分别用α1、α2表示,则α1<α2;
(4)曲线B所对应的温度是95 ℃,该温度下水的离子积常数是Kw=10-12,在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,则反应后溶液中c(OH-)=0.02mol÷2L=0.01mol/L。由于该温度下水的离子积常数是Kw=10-12,所以c(H+)=10-10,所得混合液的pH=10。
如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题。
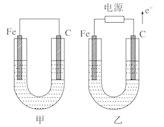
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的___________棒,乙池中的________棒。
②乙池中阳极的电极反应式是:_________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:____________________。
②甲池中碳极的电极反应式是:______________,乙池中碳极的电极反应属于_______(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池中碳极附近,发现试纸变蓝,过一段时间后又发现蓝色褪去,这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:__________________。
(1). 碳 (2). 铁 (3). 4OH--4e-=2H2O+O2↑ (4). 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- (5). 2H2O+O2+4e-=4OH- (6). 氧化反应 (7). 5Cl2+I2+6H2O=2HIO3+10HCl
Cl2↑+H2↑+2OH- (5). 2H2O+O2+4e-=4OH- (6). 氧化反应 (7). 5Cl2+I2+6H2O=2HIO3+10HCl
【解析】(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH--4e-=2H2O+O2↑。
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,乙池中总反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,2H2O+O2+4e-=4OH-,乙装置中,碳棒是阳极,发生失电子的氧化反应;
③根据题意知Cl2将生成的I2氧化,若反应的Cl2和I2物质的量之比为5∶1,则生成盐酸和碘酸两种酸,利用化合价升降法配平,该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl。
NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
(1). bc (2). bd (3). ①K=![]() (4). 80%
(4). 80%
【解析】(1)a.平衡时NH3和NO浓度关系与氨气转化率有关,不一定相等,a错误;
b.NO百分含量保持不变,说明到达平衡,b正确;
c.随反应进行,混合气体总物质的量增加,恒温恒容下容器内压强增大,当容器中气体的压强不变,说明到达平衡,c正确;
d.NH3的生成速率与NO的消耗速率均表示逆反应速率,不能说明到达平衡,NH3的生成速率与NO的生成速率相等,说明到达平衡,d错误,答案选bc;
(2)a.向装置中再充入氮气,压强增大,但物质的浓度不变,平衡不移动,氨气平衡转化率不变,a错误;
B.向装置中再充入O2,平衡显正反应方向进行,氨气平衡转化率增大,b正确;
c.改变反应的催化剂,不影响平衡移动,氨气平衡转化率不变,c错误;
d.正反应为放热反应,降低温度,平衡正向移动,氨气平衡转化率增大,d正确,答案选bd;
(3)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知平衡常数表达式K=![]() ;
;
②4NH3(g)+ 5O2 (g)![]() 4NO(g) +6H2O(g)
4NO(g) +6H2O(g)
起始浓度(mol/L) 0.05 0.06 0 0
变化浓度(mol/L) 0.04 0.05 0.04 0.06
平衡浓度(mol/L):0.01 0.01 0.04 0.06
所以氨气的转化率是![]() ×100%=80%。
×100%=80%。
常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
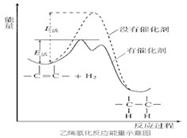
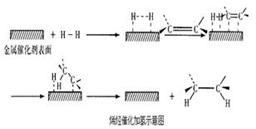
下列说法中正确的是
A. 乙烯和H2生成乙烷的反应是吸热反应
B. 加入催化剂,可减小反应的热效应
C. 催化剂能改变平衡转化率,不能改变化学平衡常数
D. 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
D
【解析】A、根据图示可知,反应物的能量高于产物的能量,所以该反应是放热反应,故A错误;
B、催化剂可以降低活化能,不会引起反应热的变化,反应的热效应不变,故B错误;
C、催化剂可以加快反应速率,不能改变平衡转化率,不能改变化学反应的平衡常数,故C错误;
D、根据化学反应的历程:化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体,故D正确;
故选D。
下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,用电解熔融氧化铝的方法
⑤钢铁表面常易锈蚀生成Fe2O3•nH2O
A. ①②③④⑤ B. ①③④⑤ C. ①③⑤ D. ②④
B
【解析】①锌跟稀硫酸反应的制取氢气,加入少量硫酸铜溶液后,金属锌可以置换金属铜,形成原电池,原电池能加速负极金属和电解质的反应速率,故①正确;②白铁(镀锌的铁)中,镀层破损后,Zn为负极,被腐蚀的是Zn,Fe被保护,马口铁(镀锡的铁)中,Fe为负极,被腐蚀的是Fe,Sn被保护,所以镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)铁更耐腐蚀,故②错误;③根据电镀原理,镀件作电解槽的阴极,故③正确;④根据金属的活动性强弱选择合适的冶炼方法,一般来说,活泼金属用电解法,铝是活泼金属,所以通常采用电解熔融氧化铝的方法冶炼,故④正确;⑤钢铁吸氧腐蚀生成的铁锈的主要成分为Fe2O3•nH2O,故⑤正确,答案选B。
本卷还有14题,登录并加入会员即可免费使用哦~

该作品由: 用户陈彤昕分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。