氮及其化合物在工农业生产中有重要应用。请回答下列问题。

(1)研究发现在常压下把氢气和氮气分别通入一个加热到570 ℃的电解池(如图)中,氢气和氮气合成了氨,而且转化率高达78%。装置中所用的电解质(图中灰色部分)能传导H+,则阴极反应为______________________________________。
(2)氨可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)等多种化工产品。已知:25 ℃时,亚硝酸(HNO2)和连二次硝酸(H2N2O2)的电离常数数值如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数数值 | Ka=5.0×10-4 | Ka1=6.2×10-8,Ka2=2.9×10-12 |
①pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO![]() )________c(HN2O
)________c(HN2O![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=________(填数值)。
(3)常温下,用0.01 mol·L-1的NaOH溶液滴定10.00 mL 0.01 mol·L-1 H2N2O2溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度的大小顺序为____________________________。
(4)常温下用0.100 mol·L-1 AgNO3溶液滴定50.0 mL 0.0500 mol·L-1 SCN-溶液的滴定曲线如图所示。已知Ksp(AgI)=1.0×10-18。下列有关描述错误的是________(填序号)。
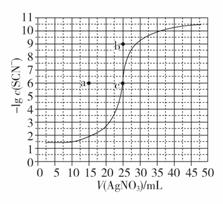
A.曲线上各点的溶液满足关系式c(Ag+)·c(SCN-)=Ksp(AgSCN)
B.相同实验条件下,若改为0.0600 mol·L-1SCN-,反应终点c向a方向移动
C.根据曲线数据计算可知Ksp(AgSCN)的数量级为10-12
D.相同实验条件下,若改为0.0500 mol·L-1 I-溶液,反应终点c向b方向移动
答案
答案 (1)N2+6H++6e-===2NH3
(2)①> ②2.0×10-11
(3)c(Na+)>c(N2O![]() )>c(OH-)>c(HN2O
)>c(OH-)>c(HN2O![]() )>c(H+) (4)B
)>c(H+) (4)B
解析 (1)氢气和氮气在酸性条件下合成氨,氮气在阴极得到电子生成氨气,阴极的电极反应式为:N2+6H++6e-===2NH3。
(2)①酸的电离常数越大,酸性越强,即亚硝酸(HNO2)和连二次硝酸(H2N2O2)的酸性强弱:HNO2>H2N2O2,所以HN2O![]() 的水解程度大,浓度相同的NaNO2溶液和NaHN2O2溶液中,c(HN2O
的水解程度大,浓度相同的NaNO2溶液和NaHN2O2溶液中,c(HN2O![]() )小,pH大,故pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO
)小,pH大,故pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO![]() )>c(HN2O
)>c(HN2O![]() )。
)。
②水解平衡常数Kb=![]() ,所以25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=
,所以25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=![]() =
=![]() =2.0×10-11。
=2.0×10-11。
(3)NaOH和H2N2O2恰好完全反应生成正盐Na2N2O2,主要离子为Na+和N2O![]() ,N2O
,N2O![]() 是二元弱酸根离子,分步水解,溶液呈碱性,由于水的电离平衡使c(OH-)>c(HN2O
是二元弱酸根离子,分步水解,溶液呈碱性,由于水的电离平衡使c(OH-)>c(HN2O![]() ),所以Na2N2O2溶液中离子浓度的大小顺序为c(Na+)>c(N2O
),所以Na2N2O2溶液中离子浓度的大小顺序为c(Na+)>c(N2O![]() )>c(OH-)>c(HN2O
)>c(OH-)>c(HN2O![]() )>c(H+)。
)>c(H+)。
(4)Ksp只与温度有关,温度不变则Ksp不变,所以曲线上各点的溶液满足关系式c(Ag+)·c(SCN-)=Ksp(AgSCN),故A正确;溶度积常数只随温度改变而改变,改变滴定反应液浓度,不改变溶度积常数,所以相同实验条件下,若改为0.0600 mol·L-1 SCN-,则所需AgNO3 溶液体积就变为![]() =30 mL,故B错误;到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lg c(SCN-)=6,则c(Ag+)=c(SCN-)=10-6 mol/L,所以根据曲线数据计算可知Ksp(AgSCN)=10-12,Ksp(AgSCN)的数量级为10-12,故C正确;因为Ksp(AgI)<Ksp(AgSCN),反应到达滴定终点时c(I-)<c(SCN-),所以终点由c向b移动,故D正确。
=30 mL,故B错误;到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lg c(SCN-)=6,则c(Ag+)=c(SCN-)=10-6 mol/L,所以根据曲线数据计算可知Ksp(AgSCN)=10-12,Ksp(AgSCN)的数量级为10-12,故C正确;因为Ksp(AgI)<Ksp(AgSCN),反应到达滴定终点时c(I-)<c(SCN-),所以终点由c向b移动,故D正确。

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L