固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是( )
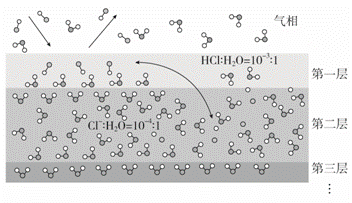
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10-3 mol·L-1(设冰的密度为0.9 g·cm-3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HClH++Cl-
答案 D
解析 由图示可知,第一层中,HCl以分子形式存在,A正确;第二层中,已知Cl-∶H2O=10-4∶1,HCl===H++Cl-,H+和Cl-的物质的量是相同的,设H2O的物质的量为1 mol,则n(H+)=10-4 mol,V(H2O)=![]() =20 cm3=0.02 L,故c(H+)=
=20 cm3=0.02 L,故c(H+)=![]() =5×10-3 mol·L-1,B正确;第三层中,只有H2O分子存在,所以冰的氢键网络结构保持不变,C正确;由A项、C项分析可知,第一层和第三层中的物质均以分子形式存在,故均不存在可逆反应HClH++Cl-,D错误。
=5×10-3 mol·L-1,B正确;第三层中,只有H2O分子存在,所以冰的氢键网络结构保持不变,C正确;由A项、C项分析可知,第一层和第三层中的物质均以分子形式存在,故均不存在可逆反应HClH++Cl-,D错误。
氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应2H2(g)+O2(g)===2H2O(g)能自发进行,该反应的ΔH<0
B.氢氧燃料电池的负极反应为O2+2H2O+4e-===4OH-
C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D.反应2H2(g)+O2(g)===2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和
答案 A
解析 2H2(g)+O2(g)===2H2O(g),反应前后气体分子数减少,ΔS<0,根据化学反应自发性的判据ΔH-TΔS<0知,该反应的ΔH<0,A正确;氢氧燃料电池的负极为H2失电子发生氧化反应,正极为O2得电子发生还原反应,B错误;常温常压下,气体摩尔体积数值未知,无法计算11.2 L H2的物质的量,故无法确定电子转移数目,C错误;ΔH=反应物的键能之和-生成物的键能之和,D错误。
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。

(1)以CO2为原料抽取碳(C)的太阳能工艺如图所示。
①过程1中每生成1 mol FeO转移电子数为________。
②过程2中发生反应的化学方程式为_____________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120 ℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为ΔH1=-283.0 kJ·mol-1
②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+![]() O2(g)CH3OCOOCH3(g)+H2O(l) ΔH=________。
O2(g)CH3OCOOCH3(g)+H2O(l) ΔH=________。
(3)在密闭容器中按n(CH3OH)∶n(CO2)=2∶1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:
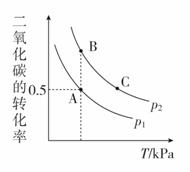
①v(A)、v(B)、v(C)由快到慢的顺序为__________;
②K(A)、K(B)、K(C)由大到小的顺序为__________;
③下列能说明在此条件下反应达到平衡状态的是________。
A.2v正(CH3OH)=v逆(CO2)
B.CH3OH与CO2的物质的量之比保持不变
C.恒容条件,容器内气体的密度保持不变
D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)
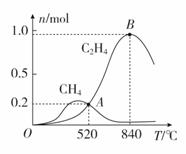
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol CO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。
①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应Ⅱ”)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为________________________________。

答案 (1)①![]() NA ②6FeO+CO2
NA ②6FeO+CO2![]() C+2Fe3O4
C+2Fe3O4
(2)-342.5 kJ·mol-1
(3)①v(C)>v(B)>v(A) ②K(A)=K(B)>K(C) ③D
(4)①反应Ⅰ ②2CO2+12H++12e-===C2H4+4H2O
解析 (1)①反应2Fe3O4![]() 6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2 mol Fe3O4参加反应,生成1 mol氧气,转移4 mol电子,则每生成1 mol FeO转移电子数为
6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2 mol Fe3O4参加反应,生成1 mol氧气,转移4 mol电子,则每生成1 mol FeO转移电子数为![]() NA。
NA。
②由示意图可知,过程2中CO2和FeO反应生成Fe3O4和C,反应的方程式为6FeO+CO2![]() 2Fe3O4+C。
2Fe3O4+C。
(2)根据CO的燃烧热有①CO(g)+![]() O2(g)===CO2(g) ΔH1=-283.0 kJ·mol-1,②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1,③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1,根据盖斯定律,所要求的方程式为上述三个方程式①+③-②即可得到,则ΔH=ΔH1-ΔH2+ΔH3=-342.5 kJ·mol-1。
O2(g)===CO2(g) ΔH1=-283.0 kJ·mol-1,②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1,③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1,根据盖斯定律,所要求的方程式为上述三个方程式①+③-②即可得到,则ΔH=ΔH1-ΔH2+ΔH3=-342.5 kJ·mol-1。
(3)①根据图像可知,温度越高速率越快,C点对应温度最高,所以v(C)最快;通过反应2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)可知,该反应是一个体积减小的可逆反应,在同一温度下,反应由A→B,二氧化碳的转化率增大,增大压强,平衡右移,因此p1<p2,B点对应的压强大,反应速率比A点快,因此v(A)、v(B)、v(C)由快到慢的顺序为v(C)>v(B)>v(A)。
②K只是温度的函数,C点对应温度最高,A、B两点对应温度相同,且低于C点;该反应为放热反应,温度升高,K减小;所以K(A)、K(B)、K(C)由大到小的顺序为K(A)=K(B)>K(C)。
③甲醇与二氧化碳反应如下:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g);根据速率之比等于系数之比规律,因此满足v正(CH3OH)=2v逆(CO2),反应才能达到平衡状态,A错误;CH3OH与CO2均为反应物,二者反应均按系数比进行,因此CH3OH与CO2的物质的量之比保持不变不能确定反应达到平衡状态,B错误;反应前后气体的总质量不变,容器的体积不变,混合气体的密度恒为定值,不能判断反应达到平衡状态,C错误;各组分的物质的量分数保持不变,反应达到平衡状态,D正确。
(4)①从图像可知,该催化剂在较低温度时,甲烷含量高,因此选择反应Ⅰ。
②根据图示可知,b为电解池的阴极,发生还原反应,二氧化碳被还原为乙烯,b电极上的电极反应式为:2CO2+12H++12e-===C2H4+4H2O。
随着现代工业的发展,二氧化碳的处理成为科学研究的重点,回答下列问题:
Ⅰ.有人提出利用H2还原CO2使其转化为有机化工的主要原料乙烯。
(1)查阅资料:H2的燃烧热为285.8 kJ·mol-1,C2H4的燃烧热为1411 kJ·mol-1,1 mol H2O(l)转化为H2O(g)需吸收44 kJ的热量。则反应6H2(g)+2CO2(g)![]() C2H4(g)+4H2O(g) ΔH=________kJ·mol-1。
C2H4(g)+4H2O(g) ΔH=________kJ·mol-1。
(2)下图是探究不同温度对CO2的转化率和催化剂的催化效率影响的示意图。
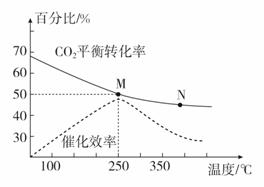
①生产中通常选用的温度最好是________,理由是____________________。
②图中表示的化学平衡常数:M________N(填“>”“<”或“=”)。
③250 ℃时,在2 L密闭容器中分别充入6 mol H2和2 mol CO2,到达平衡时体系中C2H4的体积分数为________(结果保留两位有效数字)。
Ⅱ.CO在一定条件下,能与H2合成二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。
(1)在1 L的密闭容器中分别充入2.5 mol H2与b mol CO2发生反应,在不同温度下达到平衡状态时测得实验数据如下表:
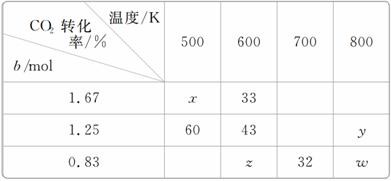
①到达平衡时若升高温度,则上述平衡向________方向移动(填“正反应”或“逆反应”)。
②转化率:x________y(填“>”“<”或“=”)。
(2)新型高效的二甲醚燃料电池工作时总反应式:CH3OCH3+3O2===2CO2+3H2O。

①该电池的负极是________(填a或b),负极电极反应式为_______________。
②利用该电池冶铝,若制得金属铝54 g理论上消耗二甲醚________g。
答案 Ⅰ.(1)-127.8 (2)①250 ℃ 此时催化剂活性最高 ②> ③7.7%
Ⅱ.(1)①逆反应 ②> (2)①a CH3OCH3+3H2O-12e-===2CO2↑+12H+ ②23
解析 Ⅰ.(1)根据H2(g)的燃烧热为285.8 kJ·mol-1,则其热化学方程式为:H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1①;CH2===CH2(g)的燃烧热为1411.0 kJ·mol-1,其热化学方程式为:C2H4(g)+3O2(g)===2H2O(l)+2CO2(g) ΔH=-1411.0 kJ·mol-1②;H2O(g)===H2O(l) ΔH=-44 kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1①;CH2===CH2(g)的燃烧热为1411.0 kJ·mol-1,其热化学方程式为:C2H4(g)+3O2(g)===2H2O(l)+2CO2(g) ΔH=-1411.0 kJ·mol-1②;H2O(g)===H2O(l) ΔH=-44 kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g) ΔH=-127.8 kJ·mol-1。
CH2===CH2(g)+4H2O(g) ΔH=-127.8 kJ·mol-1。
(2)①化学反应速率随温度的升高而加快,如题图所示,催化剂的催化效率随温度升高先增大后降低,所以从催化剂的反应活性和温度对速率、平衡的综合影响的角度考虑,最好选择250 ℃;
②升高温度,二氧化碳的平衡转化率减小,则升温平衡逆向移动,所以M点化学平衡常数大于N点;
③在2 L密闭容器中分别充入6 mol H2和2 mol CO2,由图可知250 ℃时,M点的二氧化碳转化率为50%,由方程式可得
6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g)
![]() 3 1 0 0
3 1 0 0
![]() 1.5 0.5 0.25 1
1.5 0.5 0.25 1
![]() 1.5 0.5 0.25 1
1.5 0.5 0.25 1
产物CH2===CH2的体积分数=![]() ×100%≈7.7%。
×100%≈7.7%。
Ⅱ.(1)①分析表格可知,当CO2起始物质的量为1.25 mol时,温度越低,CO2的转化率越大,说明降低温度平衡向正反应方向移动,故升高温度平衡向逆反应方向移动;
②由CO2起始物质的量为1.25 mol时,温度越高,CO2的转化率越小,说明正反应是放热反应,故结合表格可知w<32,x>33;由于CO2(g)、H2(g)按物质的量1∶3反应,H2(g)物质的量为2.5 mol,CO2的物质的量(b)越大,CO2的转化率越小,则y<w,综合上述分析可知x>33>32>w>y。
(2)①根据图知交换膜是质子交换膜,则电解质溶液呈酸性,根据电子流动方向和氢离子移动方向可知,电极a为负极、电极b为正极,负极上二甲醚失去电子发生氧化反应生成二氧化碳,负极反应式为CH3OCH3+3H2O-12e-===2CO2↑+12H+;
②根据电子守恒,可以建立关系式4Al~12e-~CH3OCH3,由此可得,若制得金属铝54 g,理论上消耗甲醇23 g。
氮及其化合物在工农业生产中有重要应用。请回答下列问题。

(1)研究发现在常压下把氢气和氮气分别通入一个加热到570 ℃的电解池(如图)中,氢气和氮气合成了氨,而且转化率高达78%。装置中所用的电解质(图中灰色部分)能传导H+,则阴极反应为______________________________________。
(2)氨可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)等多种化工产品。已知:25 ℃时,亚硝酸(HNO2)和连二次硝酸(H2N2O2)的电离常数数值如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数数值 | Ka=5.0×10-4 | Ka1=6.2×10-8,Ka2=2.9×10-12 |
①pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO![]() )________c(HN2O
)________c(HN2O![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=________(填数值)。
(3)常温下,用0.01 mol·L-1的NaOH溶液滴定10.00 mL 0.01 mol·L-1 H2N2O2溶液,当两者恰好完全反应生成正盐时,溶液中离子浓度的大小顺序为____________________________。
(4)常温下用0.100 mol·L-1 AgNO3溶液滴定50.0 mL 0.0500 mol·L-1 SCN-溶液的滴定曲线如图所示。已知Ksp(AgI)=1.0×10-18。下列有关描述错误的是________(填序号)。
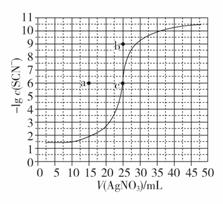
A.曲线上各点的溶液满足关系式c(Ag+)·c(SCN-)=Ksp(AgSCN)
B.相同实验条件下,若改为0.0600 mol·L-1SCN-,反应终点c向a方向移动
C.根据曲线数据计算可知Ksp(AgSCN)的数量级为10-12
D.相同实验条件下,若改为0.0500 mol·L-1 I-溶液,反应终点c向b方向移动
答案 (1)N2+6H++6e-===2NH3
(2)①> ②2.0×10-11
(3)c(Na+)>c(N2O![]() )>c(OH-)>c(HN2O
)>c(OH-)>c(HN2O![]() )>c(H+) (4)B
)>c(H+) (4)B
解析 (1)氢气和氮气在酸性条件下合成氨,氮气在阴极得到电子生成氨气,阴极的电极反应式为:N2+6H++6e-===2NH3。
(2)①酸的电离常数越大,酸性越强,即亚硝酸(HNO2)和连二次硝酸(H2N2O2)的酸性强弱:HNO2>H2N2O2,所以HN2O![]() 的水解程度大,浓度相同的NaNO2溶液和NaHN2O2溶液中,c(HN2O
的水解程度大,浓度相同的NaNO2溶液和NaHN2O2溶液中,c(HN2O![]() )小,pH大,故pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO
)小,pH大,故pH相等的NaNO2溶液和NaHN2O2溶液中:c(NO![]() )>c(HN2O
)>c(HN2O![]() )。
)。
②水解平衡常数Kb=![]() ,所以25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=
,所以25 ℃时,NaNO2溶液中存在水解平衡,其水解平衡常数Kb=![]() =
=![]() =2.0×10-11。
=2.0×10-11。
(3)NaOH和H2N2O2恰好完全反应生成正盐Na2N2O2,主要离子为Na+和N2O![]() ,N2O
,N2O![]() 是二元弱酸根离子,分步水解,溶液呈碱性,由于水的电离平衡使c(OH-)>c(HN2O
是二元弱酸根离子,分步水解,溶液呈碱性,由于水的电离平衡使c(OH-)>c(HN2O![]() ),所以Na2N2O2溶液中离子浓度的大小顺序为c(Na+)>c(N2O
),所以Na2N2O2溶液中离子浓度的大小顺序为c(Na+)>c(N2O![]() )>c(OH-)>c(HN2O
)>c(OH-)>c(HN2O![]() )>c(H+)。
)>c(H+)。
(4)Ksp只与温度有关,温度不变则Ksp不变,所以曲线上各点的溶液满足关系式c(Ag+)·c(SCN-)=Ksp(AgSCN),故A正确;溶度积常数只随温度改变而改变,改变滴定反应液浓度,不改变溶度积常数,所以相同实验条件下,若改为0.0600 mol·L-1 SCN-,则所需AgNO3 溶液体积就变为![]() =30 mL,故B错误;到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lg c(SCN-)=6,则c(Ag+)=c(SCN-)=10-6 mol/L,所以根据曲线数据计算可知Ksp(AgSCN)=10-12,Ksp(AgSCN)的数量级为10-12,故C正确;因为Ksp(AgI)<Ksp(AgSCN),反应到达滴定终点时c(I-)<c(SCN-),所以终点由c向b移动,故D正确。
=30 mL,故B错误;到达滴定终点时曲线斜率突变,图中c点为滴定终点,此处-lg c(SCN-)=6,则c(Ag+)=c(SCN-)=10-6 mol/L,所以根据曲线数据计算可知Ksp(AgSCN)=10-12,Ksp(AgSCN)的数量级为10-12,故C正确;因为Ksp(AgI)<Ksp(AgSCN),反应到达滴定终点时c(I-)<c(SCN-),所以终点由c向b移动,故D正确。
本卷还有3题,登录并加入会员即可免费使用哦~

该作品由: 用户彭杰分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。