随着现代工业的发展,二氧化碳的处理成为科学研究的重点,回答下列问题:
Ⅰ.有人提出利用H2还原CO2使其转化为有机化工的主要原料乙烯。
(1)查阅资料:H2的燃烧热为285.8 kJ·mol-1,C2H4的燃烧热为1411 kJ·mol-1,1 mol H2O(l)转化为H2O(g)需吸收44 kJ的热量。则反应6H2(g)+2CO2(g)![]() C2H4(g)+4H2O(g) ΔH=________kJ·mol-1。
C2H4(g)+4H2O(g) ΔH=________kJ·mol-1。
(2)下图是探究不同温度对CO2的转化率和催化剂的催化效率影响的示意图。
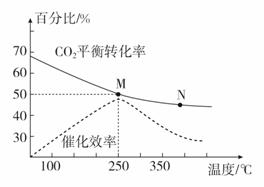
①生产中通常选用的温度最好是________,理由是____________________。
②图中表示的化学平衡常数:M________N(填“>”“<”或“=”)。
③250 ℃时,在2 L密闭容器中分别充入6 mol H2和2 mol CO2,到达平衡时体系中C2H4的体积分数为________(结果保留两位有效数字)。
Ⅱ.CO在一定条件下,能与H2合成二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。
(1)在1 L的密闭容器中分别充入2.5 mol H2与b mol CO2发生反应,在不同温度下达到平衡状态时测得实验数据如下表:
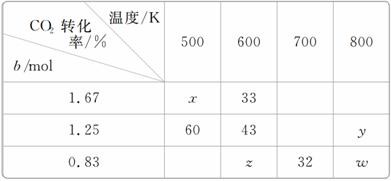
①到达平衡时若升高温度,则上述平衡向________方向移动(填“正反应”或“逆反应”)。
②转化率:x________y(填“>”“<”或“=”)。
(2)新型高效的二甲醚燃料电池工作时总反应式:CH3OCH3+3O2===2CO2+3H2O。

①该电池的负极是________(填a或b),负极电极反应式为_______________。
②利用该电池冶铝,若制得金属铝54 g理论上消耗二甲醚________g。
答案
答案 Ⅰ.(1)-127.8 (2)①250 ℃ 此时催化剂活性最高 ②> ③7.7%
Ⅱ.(1)①逆反应 ②> (2)①a CH3OCH3+3H2O-12e-===2CO2↑+12H+ ②23
解析 Ⅰ.(1)根据H2(g)的燃烧热为285.8 kJ·mol-1,则其热化学方程式为:H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1①;CH2===CH2(g)的燃烧热为1411.0 kJ·mol-1,其热化学方程式为:C2H4(g)+3O2(g)===2H2O(l)+2CO2(g) ΔH=-1411.0 kJ·mol-1②;H2O(g)===H2O(l) ΔH=-44 kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1①;CH2===CH2(g)的燃烧热为1411.0 kJ·mol-1,其热化学方程式为:C2H4(g)+3O2(g)===2H2O(l)+2CO2(g) ΔH=-1411.0 kJ·mol-1②;H2O(g)===H2O(l) ΔH=-44 kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g) ΔH=-127.8 kJ·mol-1。
CH2===CH2(g)+4H2O(g) ΔH=-127.8 kJ·mol-1。
(2)①化学反应速率随温度的升高而加快,如题图所示,催化剂的催化效率随温度升高先增大后降低,所以从催化剂的反应活性和温度对速率、平衡的综合影响的角度考虑,最好选择250 ℃;
②升高温度,二氧化碳的平衡转化率减小,则升温平衡逆向移动,所以M点化学平衡常数大于N点;
③在2 L密闭容器中分别充入6 mol H2和2 mol CO2,由图可知250 ℃时,M点的二氧化碳转化率为50%,由方程式可得
6H2(g)+2CO2(g)CH2===CH2(g)+4H2O(g)
![]() 3 1 0 0
3 1 0 0
![]() 1.5 0.5 0.25 1
1.5 0.5 0.25 1
![]() 1.5 0.5 0.25 1
1.5 0.5 0.25 1
产物CH2===CH2的体积分数=![]() ×100%≈7.7%。
×100%≈7.7%。
Ⅱ.(1)①分析表格可知,当CO2起始物质的量为1.25 mol时,温度越低,CO2的转化率越大,说明降低温度平衡向正反应方向移动,故升高温度平衡向逆反应方向移动;
②由CO2起始物质的量为1.25 mol时,温度越高,CO2的转化率越小,说明正反应是放热反应,故结合表格可知w<32,x>33;由于CO2(g)、H2(g)按物质的量1∶3反应,H2(g)物质的量为2.5 mol,CO2的物质的量(b)越大,CO2的转化率越小,则y<w,综合上述分析可知x>33>32>w>y。
(2)①根据图知交换膜是质子交换膜,则电解质溶液呈酸性,根据电子流动方向和氢离子移动方向可知,电极a为负极、电极b为正极,负极上二甲醚失去电子发生氧化反应生成二氧化碳,负极反应式为CH3OCH3+3H2O-12e-===2CO2↑+12H+;
②根据电子守恒,可以建立关系式4Al~12e-~CH3OCH3,由此可得,若制得金属铝54 g,理论上消耗甲醇23 g。


 ,
, ,所以
,所以