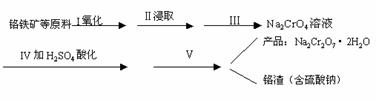
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。

(1)以CO2为原料抽取碳(C)的太阳能工艺如图所示。
①过程1中每生成1 mol FeO转移电子数为________。
②过程2中发生反应的化学方程式为_____________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120 ℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为ΔH1=-283.0 kJ·mol-1
②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+![]() O2(g)CH3OCOOCH3(g)+H2O(l) ΔH=________。
O2(g)CH3OCOOCH3(g)+H2O(l) ΔH=________。
(3)在密闭容器中按n(CH3OH)∶n(CO2)=2∶1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:
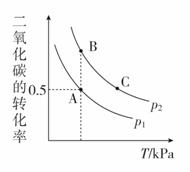
①v(A)、v(B)、v(C)由快到慢的顺序为__________;
②K(A)、K(B)、K(C)由大到小的顺序为__________;
③下列能说明在此条件下反应达到平衡状态的是________。
A.2v正(CH3OH)=v逆(CO2)
B.CH3OH与CO2的物质的量之比保持不变
C.恒容条件,容器内气体的密度保持不变
D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)C2H4(g)+4H2O(g)
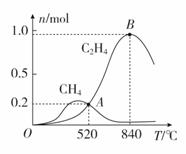
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol CO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。
①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应Ⅱ”)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为________________________________。

答案
答案 (1)①![]() NA ②6FeO+CO2
NA ②6FeO+CO2![]() C+2Fe3O4
C+2Fe3O4
(2)-342.5 kJ·mol-1
(3)①v(C)>v(B)>v(A) ②K(A)=K(B)>K(C) ③D
(4)①反应Ⅰ ②2CO2+12H++12e-===C2H4+4H2O
解析 (1)①反应2Fe3O4![]() 6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2 mol Fe3O4参加反应,生成1 mol氧气,转移4 mol电子,则每生成1 mol FeO转移电子数为
6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2 mol Fe3O4参加反应,生成1 mol氧气,转移4 mol电子,则每生成1 mol FeO转移电子数为![]() NA。
NA。
②由示意图可知,过程2中CO2和FeO反应生成Fe3O4和C,反应的方程式为6FeO+CO2![]() 2Fe3O4+C。
2Fe3O4+C。
(2)根据CO的燃烧热有①CO(g)+![]() O2(g)===CO2(g) ΔH1=-283.0 kJ·mol-1,②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1,③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1,根据盖斯定律,所要求的方程式为上述三个方程式①+③-②即可得到,则ΔH=ΔH1-ΔH2+ΔH3=-342.5 kJ·mol-1。
O2(g)===CO2(g) ΔH1=-283.0 kJ·mol-1,②H2O(l)===H2O(g) ΔH2=+44.0 kJ·mol-1,③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g) ΔH3=-15.5 kJ·mol-1,根据盖斯定律,所要求的方程式为上述三个方程式①+③-②即可得到,则ΔH=ΔH1-ΔH2+ΔH3=-342.5 kJ·mol-1。
(3)①根据图像可知,温度越高速率越快,C点对应温度最高,所以v(C)最快;通过反应2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)可知,该反应是一个体积减小的可逆反应,在同一温度下,反应由A→B,二氧化碳的转化率增大,增大压强,平衡右移,因此p1<p2,B点对应的压强大,反应速率比A点快,因此v(A)、v(B)、v(C)由快到慢的顺序为v(C)>v(B)>v(A)。
②K只是温度的函数,C点对应温度最高,A、B两点对应温度相同,且低于C点;该反应为放热反应,温度升高,K减小;所以K(A)、K(B)、K(C)由大到小的顺序为K(A)=K(B)>K(C)。
③甲醇与二氧化碳反应如下:2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g);根据速率之比等于系数之比规律,因此满足v正(CH3OH)=2v逆(CO2),反应才能达到平衡状态,A错误;CH3OH与CO2均为反应物,二者反应均按系数比进行,因此CH3OH与CO2的物质的量之比保持不变不能确定反应达到平衡状态,B错误;反应前后气体的总质量不变,容器的体积不变,混合气体的密度恒为定值,不能判断反应达到平衡状态,C错误;各组分的物质的量分数保持不变,反应达到平衡状态,D正确。
(4)①从图像可知,该催化剂在较低温度时,甲烷含量高,因此选择反应Ⅰ。
②根据图示可知,b为电解池的阴极,发生还原反应,二氧化碳被还原为乙烯,b电极上的电极反应式为:2CO2+12H++12e-===C2H4+4H2O。


 ,
, ,所以
,所以