分析下图的能量变化,确定该反应的热化学方程式书写正确的是
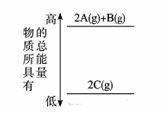
A. 2A(g)+B(g)===2C(g) ΔH<0
B. 2A(g)+B(g)===2C(g) ΔH>0
C. 2A+B===2C ΔH<0
D. 2C===2A+B ΔH<0
答案
【答案】A
【解析】
【分析】
根据反应热与反应物总能量、生成物总能量的关系分析解答。
【详解】题图表示2molA(g)和1molB(g)具有的总能量高于2molC(g)具有的总能量,则可写热化学方程式:2A(g)+B(g)=2C(g) ΔH<0,或2C(g)=2A(g)+B(g) ΔH>0 。A项正确、B项错误;C项、D项都未写物质状态,都错误。
本题选A。
【点睛】反应热ΔH=生成物总能量-反应物总能量。ΔH是变化过程中各种形式能量之总和,而不仅指热量。




 等
等