某校化学兴趣小组实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
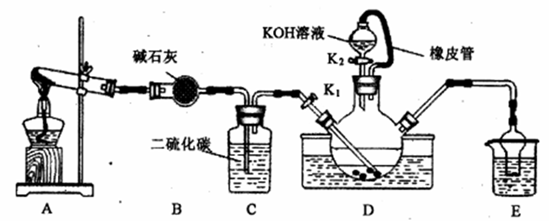
实验步骤如下:
(1)制备 NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S。该反应比较缓慢。
NH4SCN+H2S。该反应比较缓慢。
①实验前,应进行的操作是______________________。三颈烧瓶内盛放有CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是______________________。
②实验开始时打开K1,加热装置A、D,缓缓地向装置D中充入气体。装置A中的物质是___________(以化学式表示),装置C的作用可能是______________________。
(2)制备KSCN溶液:移去A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是_________________________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,___________,过滤,干燥,得到硫氰化钾晶体。
(4)测定KSCN的含量称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是___________。
②KSCN的质量分数为___________。
答案
【答案】 (1). 检查装置的气密性 (2). 使反应物充分接触,防止发生倒吸 (3). NH4Cl、Ca(OH)2 (4). 观察气泡速率,控制加热温度 (5). NH4SCN+KOH![]() KSCN+NH3+H2O (6). 冷却结晶 (7). 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 (8). 97.0%
KSCN+NH3+H2O (6). 冷却结晶 (7). 当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复 (8). 97.0%
【解析】
【分析】
本题主要考察实验基本操作、陌生反应方程式的推断和书写、滴定的终点判断和相关计算。
【详解】(1)、①连接好装置后,实验前必须进行的一步操作是检查装置的气密性。根据相似相溶原理可知,氨气易溶于水、不易溶于二硫化碳,因此,为了使反应物充分接触,防止发生倒吸,所以三颈烧瓶的下层CS2液体必须浸没导气管口。
本题答案:检查装置的气密性;使反应物充分接触,防止发生倒吸
②制备 NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,反应需NH3,所以A装置为氨气发生器,实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。故装置A中的物质是NH4Cl , Ca(OH)2,装置C的作用可能是观察气泡速率,控制A装置的加热温度。
NH4SCN+H2S,反应需NH3,所以A装置为氨气发生器,实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。故装置A中的物质是NH4Cl , Ca(OH)2,装置C的作用可能是观察气泡速率,控制A装置的加热温度。
本题答案:NH4Cl , Ca(OH)2;观察气泡速率,控制加热温度
(2)、在装置C中发生反应得NH4SCN,装置D耐碱分液漏斗中装入的碱与NH4SCN发生反应生成硫氰化钾,故D中的反应化学方程式为NH4SCN+KOH![]() KSCN+NH3↑+H2O
KSCN+NH3↑+H2O
本题答案:NH4SCN+KOH![]() KSCN+NH3↑+H2O
KSCN+NH3↑+H2O
(3)、制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、冷却结晶、过滤、干燥,得到硫氰化钾晶体。
本题答案:冷却结晶
(4)、①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,以Fe(NO3)3为指示剂, SCN-与Fe3+反应使溶液呈血红色。当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复,即为终点。
本题答案:当滴入最后一滴AgNO3溶液时,红色恰好褪去,且半分钟内颜色不恢复
②20.00mL 0.1000mol/LAgNO3标准溶液滴定,c(Ag+)=0.1000mol/L╳0.02 L=0.002 mol,根据滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,可知20.00mL 中c(SCN-)= 0.002 mol,则1000mL 中c(SCN-)为0.1 mol,KSCN的质量分数=97.0g/ mol╳0.1 mol/10g╳ 100%=97.0%
本题答案:97.0%

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L