氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)CN-中C元素显+2价,N元素显-3价,则非金属性N____________C (填“>”“<”或“=”),请设计实验证明:____________________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是____________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
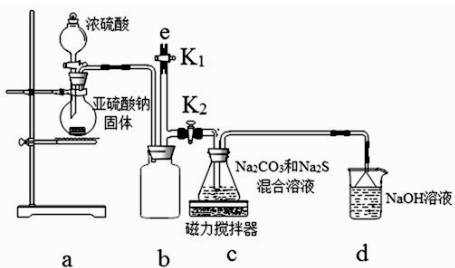
(3)b装置的作用是________________________。c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__________________________________________________________。
(4)实验结束后,在e处最好连接盛____________(填“NaOH溶液”、“水”、“CCl4”中一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且 CN-优先与 Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指 示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定终点的现象:________________________________________________。
(6)处理后的废水是否达到排放标准:____________________________________ (填“是”或“否”)。
答案
【答案】 (1). > (2). 取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C (3). CN-+H2O2+H2O═HCO3-+NH3↑ (4). 安全瓶,防止倒吸 (5). Na2SO3 (6). NaOH溶液 (7). 滴入最后一滴硝酸银溶液,出现淡黄色沉淀 (8). 否
【解析】
【分析】
(1)在化合物中非金属性强的元素显负价,非金属性弱的元素显正价,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,据此设计实验;
(2)NaCN用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气和碳酸氢钠;
(3)由仪器结构特征,b装置为安全瓶,防止溶液倒吸;d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;关闭K2打开K1拆除装置,防止污染空气;
(5)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
(6)计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量与废水中氰化钠的最高排放标准为0.50mg/L比较判断是否符合排放标准。
【详解】(1)在化合物中非金属性强的元素显负价,非金属性弱的元素显正价,CN-中C元素显+2价,N元素显-3价,则非金属性N>C,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,设计实验为取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C,
故答案为:>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C。
(2)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,离子反应为:CN-+H2O2+H2O═HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O═HCO3-+NH3↑。
【实验一】a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,装置b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(3)由仪器结构特征,可知b装置为安全瓶,防止倒吸,d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,
故答案为:安全瓶,防止倒吸;Na2SO3。
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1,防止拆除装置时污染空气,
故答案为:NaOH溶液。
【实验二】(5)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,
故答案为:滴入最后一滴硝酸银溶液,出现淡黄色沉淀。
(6)消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为1.47×10−2mg÷0.0200L=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准,
故答案为:否。


