氮化镁(Mg3N2)在工业上应用广泛,通常条件下为黄绿色粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备 下面是甲、乙两位学生提出的制备氮化镁的实验方案示意图(实验前系统内的空气已排除。图中箭头表示气体的流向)。
甲. ![]()
乙. ![]()
(1)Mg3N2的电子式为___________,甲同学的实验方案不能顺利制得氮化镁,原因为________________
(用化学方程式表示)。
(2)乙同学方案中NaOH固体的作用为_____________________________________________。
(3)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案 (夹持装置略去):
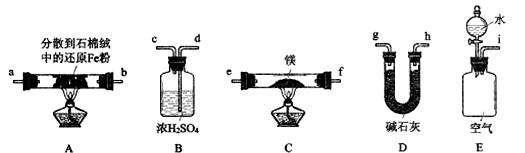
① 按气流由左到右的方向,上述装置合理的连接顺序为____________(填接口字母);
② 装置B的作用为___________,装置D的作用为__________________________。
Ⅱ.定性分析产物
| 操作步明 | 实验现象 | 解释原因 |
| 取少量产品于试管中,加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | (4)反应的化学方程式为___________ |
| . |
| 弃去上层淸液,加入足量稀盐酸 | 观察到固体全部溶解,且有气泡冒出 | (5)气泡冒出的原因为_____________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0 g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1.00 mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL;
ii.取20.00 mL稀释后的溶液,用0.2 mol/L NaOH标准溶液滴定过量的盐酸,达到终点时消耗标准溶液25.00 mL。
(6)产物中氮化镁的质量分数为_______________。
答案
(1)![]() (2分);
(2分);
2NH3 + H2SO4 = (NH4)2SO4 或NH3 + H2SO4 = NH4HSO4(1分)
(2)固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-向生成NH3的方向移动。(2分)
NH4+ +OH-向生成NH3的方向移动。(2分)
(3)①i-g-h-a-b-e-f-d-c(2分)
②防止外界空气进入装置C使Mg3N2变质(1分);吸收空气中的CO2和H2O,防止与镁反应(2分)
(4)Mg3N2+6H2O=3Mg(OH)2+2NH3↑(2分)
(5)未反应的镁与盐酸反应产生氢气(1分)
(6)62.5%(2分)


