某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:
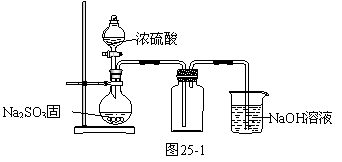 (1)用图25-1装置制取并收集SO2以验证其氧化性
(1)用图25-1装置制取并收集SO2以验证其氧化性
①实验时为控制SO2产生的快慢,应采取的措施是 。
②烧杯中NaOH溶液的作用是 。
③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,则反应后生成的含硫物质可能是 (填化学式)。
④若将集气瓶换成盛有Na2S溶液的广口瓶,发现通气一段时间后产生大量淡黄色浑浊,经测定,产物中还有一种相对分子质量为104的酸式盐。则该反应的离子方程式为 。
(2)用图25-2装置验证H2SO3比H2CO3酸性强
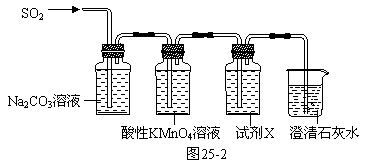 |
⑤试剂X是 ,其作用是 。
⑥当观察到 ,即证明H2SO3比H2CO3酸性强。
答案
1)①控制浓硫酸滴加的速度 ②吸收SO2气体,防止污染环境
③S、MgS、MgSO3 ④2S2-+ 5SO2+2H2O=3S↓+4HSO3-
(2)⑤品红溶液 检验SO2是否除尽
⑥品红溶液不褪色,澄清石灰水变浑浊


