知识点选择

-
难度:




 使用次数:203
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:203
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析某人设计的糖厂甘蔗渣利用方案如下图所示:
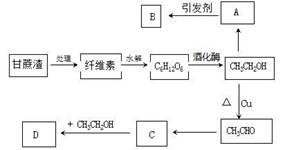
其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。
请回答以下问题:
(1)“C6H12O6”所示的物质的名称是_________,A的电子式为_______________。
(2)写出下列转化的化学方程式并指出反应类型:
A→B___________________________________,反应类型__________________。
C→D____________________________________,反应类型__________________。
CH3CH2OH→CH3CHO:___________________________________,反应类型__________________。
题型:推断题 知识点:有机物的合成与推断 -
难度:




 使用次数:201
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:201
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析常温下氨气能被氯气氧化生成N2,化工厂常用此法检验管道是否泄漏氯气。某探究小组在实验室对氨气与氯气反应进行了探究,回答下列问题。
Ⅰ.氨气的制备
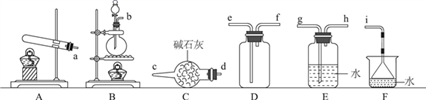
(1)氨气的发生装置可以选择上图中的________(填大写字母),反应的化学方程式为____________________________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,按气流方向写出其接口的连接顺序:发生装置管口→________(填小写字母)。
Ⅱ.氯气与氨气的反应
室温下,用收集到的氨气按下图所示装置进行实验(实验前k1、k2关闭)。
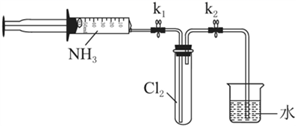
(3)打开k1,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭k1,恢复室温。试管中可观察到的现象是________。发生反应的化学方程式为________。
(4)再打开k2,可观察到的现象是________。
题型:实验,探究题 知识点: -
难度:




 使用次数:185
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:185
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析乙酸乙酯是无色具有水果香味的液体,沸点为77.2℃,实验室某次制取它用冰醋酸14.3mL、95%乙醇23mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液,主要装置如图所示:
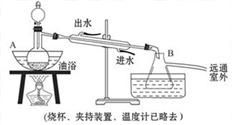
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_________________________。
(2)用过量乙醇的主要目的是____________________________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是_______________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_______________________。
(5)在步骤⑧所得的粗酯里还含有的杂质是_____________________。
题型:实验,探究题 知识点: -
难度:




 使用次数:186
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:186
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4
 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
题型:综合题 知识点:第一节 化学反应速率 -
难度:




 使用次数:267
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:267
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析现有七种短周期元素①H、②C、③N、④O、⑤Na、⑥ Al、⑦Cl。
(1)①与③形成的简单氢化物的电子式是__________________,工业上利用该化合物制备NO的化学方程式_________________________________。
(2)⑤的单质在④的单质中燃烧,生成淡黄色固体。该产物中含有的化学键的类型是______________。
(3)②和⑦的气态氢化物中热稳定性较强的是__________(用化学式表示);能表示出②和⑦最高价氧化物水化物的酸性强弱的离子方程式是______________________________。
(4)①-⑦几种元素中,最高正价氧化物为两性的是__________(用化学式表示);写出它与氢氧化钠反应的化学方程式 __________________________________________。
题型:填空题 知识点: -
难度:




 使用次数:260
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:260
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析O3在水中易分解。一定条件下,起始浓度均为0.0216mol/L的O3溶液,在不同的pH、温度下,发生分解反应,测得O3浓度减少一半所需的时间(t)如下表所示:
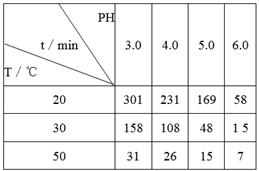
下列判断不正确的是
A.实验表明,升高温度能加快O3的分解速率
B.pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用
C.在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L·min)
D.据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0)
题型:选择题 知识点:第一节 化学反应速率 -
难度:




 使用次数:189
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:189
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。X和Z为同主族元素,由X、Z两种元素形成的化合物是形成酸雨的主要物质。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Z与Y属于同一周期
D.W、X、Y、Z原子的核外最外层电子数的总和为20
题型:选择题 知识点: -
难度:




 使用次数:202
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:202
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列有关海水综合利用的说法正确的是
A.利用电解的方法可以从海水中获取淡水
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.海水蒸发制海盐的过程只发生了化学变化
D.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
题型:选择题 知识点: -
难度:




 使用次数:294
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:294
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析用如下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
题型:选择题 知识点:第二节二氧化硫 -
难度:




 使用次数:280
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:280
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列各组有机物中,仅使用溴水不能鉴别出的是
A.乙烯、乙炔 B.苯、四氯化碳
C.乙烷、乙烯 D.苯、酒精
题型:选择题 知识点: -
难度:




 使用次数:264
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:264
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列变化属于物理变化的是( )
A.石油分馏 B.煤的液化 C.蛋白质变性 D.石油裂化
题型:选择题 知识点:第四节 蛋白质 -
难度:




 使用次数:260
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:260
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列不属于高分子化合物的是( )
A.纤维素 B.聚氯乙烯 C.淀粉 D.油脂
题型:选择题 知识点: -
难度:




 使用次数:210
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:210
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析在一定条件下,对于密闭容器中进行的可逆反应:H2(g)+I2(g)
 2HI(g),达到化学平衡状态的标志是( )
2HI(g),达到化学平衡状态的标志是( )A.正、逆反应速率都等于零 B.H2、I2的浓度相等
C.HI、H2、I2在容器中共存 D.HI、H2、I2的浓度均不再变化
题型:选择题 知识点:第二节 化学平衡 -
难度:




 使用次数:262
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:262
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列表示的是化学反应 A+2B=C+D 在不同条件下的反应速率,其中最快的是
A.v(A)=0.3mol∙L-1∙s-1 B.v(B)=0.5mol∙L-1∙s-1
C.v(C)=0.25mol∙L-1∙s-1 D.v(D)=0.2mol∙L-1∙s-1
题型:选择题 知识点:第一节 化学反应速率 -
难度:




 使用次数:294
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:294
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析锌与过量的稀盐酸反应,为了加快反应速率,又不影响生成氢气的总量,可以采取的措施是( )
A.加入浓盐酸 B.加入一定量CuSO4固体 C.加入适量的水 D.降低温度
题型:选择题 知识点: -
难度:




 使用次数:245
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:245
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析在下列过程中,需要加快反应速率的是( )
A.食物变质 B.合成氨 C.钢铁腐蚀 D.塑料老化
题型:选择题 知识点: -
难度:




 使用次数:110
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:110
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是( )
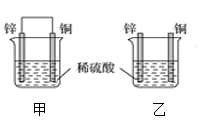
A.两烧杯中溶液的pH均增大
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中铜片表面均无气泡产生
D.产生气泡的速度甲比乙慢
题型:选择题 知识点: -
难度:




 使用次数:188
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:188
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析有关电化学知识的描述正确的是
A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.原电池的两极一定是由活动性不同的两种金属组成
C.从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
D.原电池工作时,正极表面一定有气泡产生
题型:选择题 知识点: -
难度:




 使用次数:223
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:223
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是

A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
题型:选择题 知识点:第三节 化学反应中的能量变化 -
难度:




 使用次数:126
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析
使用次数:126
入库时间:2021-01-26来源: 贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题含答案解析下列关于能量转化的说法中正确的是( )
A.给手机充电时:化学能转化为电能
B.铅蓄电池的放电过程:电能转化为化学能
C.氢气在氧气中燃烧:化学能转化为热能和光能
D.植物的光合作用:生物质能(化学能)转化为光能(太阳能)
题型:选择题 知识点:第三节 化学反应中的能量变化