一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。

下列有关说法正确的是( )
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
【错误分析】错选A或C,错选A,当 x=2时,v(B)=(0.3-0.1)/2=0.1 mol/(L·min);错选C,若增大![]() c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
c(C),反应将向逆反应方向移动,B的物质的量增大,所以B的物质的量分数增大。错选A是没有看清楚图,纵轴表示物质的物质的量,而反应速率的公式中分子是浓度的变化;错选C是模糊了物质的量和物质的量分数之间的关系,物质的量增加并不意味着物质的量分数增加。
【答案】D。
【状元纠错】本题主要涉及化学平衡图象的识别和判断,图1是浓度-时间图,图2为速率-时间图,A中,当 x=2时,v(B)=(0.3-0.1)/2/2=0.05 mol/(L·min),B中此反应△H<0,降温平衡正向移动。C中结合图2逆反应速率增大,平衡逆向移动,B的物质量增大,但是总的物质的量也在增大,所以无法确定B的物质的量分数不一定增大。D项中改变压强,平衡不移动,使用催化剂,平衡亦不移动。
下列关于四个图像的说法正确的是 ( )
 |
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H大于0
B.图②为氢氧燃料电池示意图,正、负极通入气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
【错误分析】错选B或D,氢氧燃料电池总反应为2H2+O2=2H2O,由方程式可知道氢氧体积比就为2:1所以选B;错选D,依据“先拐先平”的原理,乙的压强大比甲的大。错选B忽略了正负极的问题,在正极放电是氧气,在负极放电是氢气,正、负极通入气体体积之比为1:2;错选D忽略了物质的状态,反应前后压强并不相等。
【答案】C。
【状元纠错】A中表示为放热反应,△H小于0,B中氢氧燃料电池总反应为2H2+O2=2H2O,由方程式可知道氢氧体积比就为2:1,C中b随温度变化溶解度变化不大,而a溶解度变化很大,所以可以用结晶方法从a、b混合物中提纯a;D中不能表示压强对平衡的影响,因为压强不同,平衡时各组分的百分含量也不同,而图示为压强不同平衡时各组分的百分含量相同。
3molA和2.5molB混合于2L密闭容器中,发生如下反应:
![]()
5分钟后,反应达到平衡,测得C的平均速率为0.1mol·L-1·min-1并生成1molD。求①VA,VD;②x;③αB;④[C]平


由D的变化量根据各物质的变化量和方程式系数成正比解出:x=2;B的变化量为0.5mol,进而解出B的转化率为20%;C在平衡时,其物质的量为1mol,其浓度为0.5mol·L-1。
【状元纠错】①VA=0.15mol·L-1·min-1;VD=0.1mol·L-1·min-1
在一个不传热的固定容积的密闭容器中,可逆反应N2(气)
![]()
![]()
不再发生变化④混合气体的密度不变(相同状况)⑤体系的温度不再发
![]()
H—H断键反应同时2molN—H也断键反应
A.①②③⑤⑥ B.②③④⑤⑥
C.②③⑤⑥ D.②③④⑥⑦
【答案】 B
【解析】达到化学平衡状态的标志是平衡理论里一个重要的基本概念,当外界条件一定时,若正反应速率等于逆反应速率,反应混合![]() 物中各物质的百分组成不变,化学反应达到平衡状态。我们不仅要了解概念的定义,而且还应了解其表现的多样性和其实质。误选A的原因是将化学反应速率和化学平衡中的正、逆反应速率混为一谈。教材中给反应速率下了如下定义:通常用单位时间内反应物的浓度减小或生成物的浓度增大来表示,这仅表示是正反应速率。另由化学反应中各物质的变化量与反应方程式的系数成比例,推导出:在化学反应中各物质的反应速率与方程式的系数成正比,即①所示,也只能表示正反应速率,而不能表示正、逆反应速率之间的关系。⑥说明:N2减少的速率和NH3(作为逆反应的反应物)减少的速率与方程式的系数成正比,如单位时间内1mol·L-1的氮气参加反应,生成2mol·L-1的氨,同时2mol·L-1的氨气也参加反应生成1mol·L-1的氮气,正、逆反应速率相等,应为平衡的标志。
物中各物质的百分组成不变,化学反应达到平衡状态。我们不仅要了解概念的定义,而且还应了解其表现的多样性和其实质。误选A的原因是将化学反应速率和化学平衡中的正、逆反应速率混为一谈。教材中给反应速率下了如下定义:通常用单位时间内反应物的浓度减小或生成物的浓度增大来表示,这仅表示是正反应速率。另由化学反应中各物质的变化量与反应方程式的系数成比例,推导出:在化学反应中各物质的反应速率与方程式的系数成正比,即①所示,也只能表示正反应速率,而不能表示正、逆反应速率之间的关系。⑥说明:N2减少的速率和NH3(作为逆反应的反应物)减少的速率与方程式的系数成正比,如单位时间内1mol·L-1的氮气参加反应,生成2mol·L-1的氨,同时2mol·L-1的氨气也参加反应生成1mol·L-1的氮气,正、逆反应速率相等,应为平衡的标志。
误选D的原因是疏忽大意较多,忽略了每mol氨分子含有3molN—H键,单位时间内3molH—H断键反应同时6molN—H也断键反应才能表示正、逆反应速率相等。
![]() 误选C是
误选C是![]() 认为④不是达到平衡的标志,其原因是思维定势和综合应用能力较弱。物质的密度等于其质量除以体积,对于固体或液体来说,由于其体积随温度或压强变化不大,因此一般不考虑随状态的变化。但气体体积是状态的函数,随状态变化而由较大的变化,如果不是在相同状态下比较密度,就失去其意义。该反应是气体
认为④不是达到平衡的标志,其原因是思维定势和综合应用能力较弱。物质的密度等于其质量除以体积,对于固体或液体来说,由于其体积随温度或压强变化不大,因此一般不考虑随状态的变化。但气体体积是状态的函数,随状态变化而由较大的变化,如果不是在相同状态下比较密度,就失去其意义。该反应是气体![]() 总体积减少的放热反应,反应又在一个不传热的固定容积的密闭容器中进行,混合气体的密度变化一定存在,换算较为复杂。是否可从混合气体的平均摩尔质量入手,而气体的密度之比又等于其摩尔质量之比,问题就变为简单。本反应的气体总质量不变(反应物和生成物皆为气体),混合气体的物质的量减小,平均摩尔质量增大,密度增大,密度不变应视为达到平衡的标志。
总体积减少的放热反应,反应又在一个不传热的固定容积的密闭容器中进行,混合气体的密度变化一定存在,换算较为复杂。是否可从混合气体的平均摩尔质量入手,而气体的密度之比又等于其摩尔质量之比,问题就变为简单。本反应的气体总质量不变(反应物和生成物皆为气体),混合气体的物质的量减小,平均摩尔质量增大,密度增大,密度不变应视为达到平衡的标志。
【状元纠错】总之对达到化学平衡状态的标志描述是多方面的:从微观上分析,单位时间内形成化学键的键数,得失电子数……等都可以表示反应速率;从宏观上分析,各物质的浓度,体系内物质的颜色,体系的压强,体系的温度,混合气体的平均摩尔质量……等都可以反映出各物质的百分组成变化。在表示反应速率时,一定是表示正反应速率和逆反应速率相等。在讨论百分组成变化时,要注意观察方向,如气体的颜色;适用的范围,如从压强、混合气体的平均摩尔质量上判断,仅适用于反应前后气体的物质的量不等的反应。
一真空密![]() 闭容器中盛有amolA,加热到200℃时发生如下反
闭容器中盛有amolA,加热到200℃时发生如下反
![]()
数为M%。若在同一温度和同一容器中,最初投入的是2amolA,反应平衡时,A所占体积分数为N%。则M和N的正确![]() 关系是
关系是
A.M>N B.M<N C.M=N D.无法比较
【答案】D
【解析】在同温、同体积条件下,反应物投入的量由amol增加到2amol,讨论A所占体积分数如何变化。
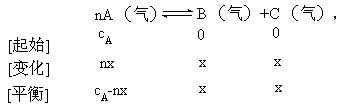
由于A所占体积分数受到两方面的制约,即A的大小(cA-nx)和总体积的大小(cA-nx+2x),而这两个量都是变量,因此其比值如何变化难以确定。另一方面反应物只有一种物质,增加其量是从增大浓度分析还是从加大压强考虑。知识的缺陷和分析方法的不当,往往得出以上各种错误的选择。
本题一种![]() 简捷思考方法是:当A的量增大一倍时,先将容器的体积也扩大一倍(其状况和第一次完全相同),这样达到平衡时,A所占体积分数不变。然后再将体积压缩到原状态,这时根据反应前后的气体体积数如何变化,考虑平衡如何移动,决定A所占体积分数如何变化。如当本题反应物A前的系数n等于1,由于反应前气体的总体积数小于反应后气体的总体积数,因此在压缩到原状态时,
简捷思考方法是:当A的量增大一倍时,先将容器的体积也扩大一倍(其状况和第一次完全相同),这样达到平衡时,A所占体积分数不变。然后再将体积压缩到原状态,这时根据反应前后的气体体积数如何变化,考虑平衡如何移动,决定A所占体积分数如何变化。如当本题反应物A前的系数n等于1,由于反应前气体的总体积数小于反应后气体的总体积数,因此在压缩到原状态时,
![]()
大,A所占体积分数增大,即N>M。若n等于3,由于反应前气体的总体积数大于反应后气体的总体积数,因此在压缩到原状态时,平衡将
![]()
减少,A所占体积分数减小,其结果为M>N。若n等于2,在压缩到原状态时,平衡不移动,其结果为M=N。
【状元纠错】由于A所占体积分数受到两方面的制约,即A的大小和总体积的大小,而这两个量都是变量,其比值如何变化难以确定。
本卷还有10题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。