下列说法错误的是
A.越王勾践剑(青铜)的铸造材料主要是铜锡合金
B.青花瓷制作原料的主要成分是硅酸盐
C.以毛竹为原料制作的竹纤维属于高分子材料
D.石墨烯是一种能导电的有机高分子材料
D
【详解】
A.越王勾践剑是春秋晚期越国青铜器,铸造材料主要是铜锡合金,故A正确;
B.青花瓷的制造原料为黏土,属于硅酸盐,故B正确;
C.高分子化合物相对分子质量很大,一般在10000以上,可高达几百万,以毛竹为原料制作的竹纤维,主要成分为纤维素,是高聚物,属于有机合成高分子材料,故C正确;
D.“石墨烯”是一种碳的单质,为无机物,不是新型有机高分子材料,故D错误;
故选:D。
对二乙烯苯(![]() )可用作树脂、油漆及特种橡胶的原料下列说法正确的是
)可用作树脂、油漆及特种橡胶的原料下列说法正确的是
A.分子中所有原子可共平面 B.一氯代物有4种(不考虑立体异构)
C.不能使酸性高锰酸钾溶液褪色 D.1mol该分子最多可与2mol H2加成
A
【详解】
A.乙烯、苯分子中所有原子共平面,对二乙烯苯可看成苯环上的两个H原子被两个乙烯基代替,碳碳单键可以旋转,所以该分子中所有原子可能共平面,故A正确;
B.该分子结构对称,苯环上的一氯代物有1种,取代基上的一氯代物有2种,共有3种一氯代物,故B错误;
C.含有碳碳双键,可以被酸性高锰酸钾氧化,从而使酸性高锰酸钾溶液褪色,故C错误;
D.苯环和碳碳双键都可以与氢气加成,所以1mol该分子最多可与5molH2加成,故D错误;
故答案为A。
NA代表阿伏加德罗常数的值,下列叙述正确的是
A.17g H2S与PH3组成的混合气体中含有的质子数为9NA
B.4.6g分子式为C2H6O的有机物中含有C—H键数为0.5NA
C.常温下,将5.6g铁块投入足量浓硝酸中,转移电子数为0.3NA
D.一定条件下,1mol H2与足量碘蒸气充分反应,生成HI分子数一定小于NA
A
【详解】
A.H2S与PH3的摩尔质量均为34g/mol,故17g混合物的物质的量为0.5mol,且两者均含18个质子,故0.5mol混合物中含质子为9NA个,故A正确;
B.C2H6O可能的结构有CH3OCH3或CH3CH2OH,前者有6个C—H键,后者有5个C—H键,所以4.6g分子式为C2H6O的有机物中含有C—H键数目无法确定,故B错误;
C.常温下,铁在浓硝酸中钝化,故C错误;
D.I2和H2的反应为可逆反应,不能进行彻底,1mol H2与足量碘蒸气充分反应,生成的HI的分子数小于2NA个,可能为NA个,故D错误;
故答案为A。
实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
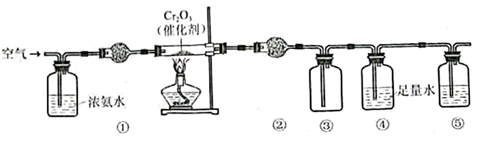
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
D
【分析】
空气通入浓氨水后,氨气和氧气的混合气体经过碱性干燥剂干燥后进入装有催化剂的硬质玻璃管,发生催化氧化产生NO,生成的气体经过酸性干燥剂(或无水氯化钙),除去氨气和水蒸气,在装置③中NO与空气中的氧气反应生成NO2,并收集,④中的水可以吸收排出的二氧化氮产生硝酸,尾气中的NO2、NO在⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液,以此解答该题。
【详解】
A.根据上述分析,装置①、②、⑤可依次盛装碱性干燥剂、酸性干燥剂、NaOH溶液,碱石灰为碱性干燥剂,可以干燥氨气,P2O5属于酸性干燥剂可以吸收氨气并干燥,故A正确;
B.装置③中NO被氧化生成NO2,气体呈红棕色,故B正确;
C.装置④中发生3NO2+H2O=2HNO3+NO,溶液显酸性,可使紫色石蕊溶液变红,故C正确;
D.通空气的主要作用是鼓出氨气并提供氧气,空气不能用N2代替,故D错误;
故选:D。
当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是

A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
C
【分析】
断开K1,闭合K2后,形成浓差电池,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液,Ag+浓度越大离子的氧化性越强,可知A为正极,发生还原反应,B为负极,发生氧化反应,![]() 向负极移动;闭合K1,断开K2,为电解装置,与电源正极相连的B极为阳极,阳极金属银被氧化,阴极A析出银,
向负极移动;闭合K1,断开K2,为电解装置,与电源正极相连的B极为阳极,阳极金属银被氧化,阴极A析出银,![]() 向阳极移动,乙池浓度增大,甲池浓度减小,据此解答。
向阳极移动,乙池浓度增大,甲池浓度减小,据此解答。
【详解】
A.断开K1,闭合K2后,形成浓差电池,当两池银离子浓度相等时,反应停止,电流计指针将归零,A选项正确;
B.断开K1,闭合K2后,形成浓差电池,A为正极,发生反应:Ag++e-=Ag,B为负极,发生反应为:Ag-e-=Ag+,当转移0.1 mol电子,有0.1 mol![]() 由甲池通过离子交换膜进入乙池,所以乙池增加的质量是10.8g+6.2g=17.0g,B选项正确;
由甲池通过离子交换膜进入乙池,所以乙池增加的质量是10.8g+6.2g=17.0g,B选项正确;
C.闭合K1,断开K2后,乙池中的B极为电解池的阳极,银失电子发生氧化反应,质量减小,C选项错误;
D.闭合K1,断开K2后,装置为电解池,与电源正极相连的B是阳极,阳极金属银被氧化产生银离子,NO3-向阳极移动,则乙池硝酸银溶液的浓度增大,D选项正确;
答案选C。
【点睛】
本题综合考查电解池和原电池的工作原理,原电池的负极和电解池的阳极失去电子发生氧化反应;原电池的正极和电解池的阴极得到电子发生还原反应,对于电解池,若阳极为活性电极,则电极失去电子;若为惰性电极,则是溶液中的阴离子失去电子,发生氧化反应。
本卷还有19题,登录并加入会员即可免费使用哦~

该作品由: 用户孙良萌分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。