以下物质在水中不能形成溶液的是
A.酒精 B.味精 C.面条 D.白糖
C
【解析】
分析:一种或几种物质分散到另一种物质中,形成均一、稳定的混合物叫做溶液,它的基本特征是均一性和稳定性。只有被分散的物质在水中是可溶的,二者混合才能形成溶液。
详解:A. 酒精易溶于水,形成均一、稳定的混合物,属于溶液,故A错误;B. 味精易溶于水,形成均一、稳定的混合物,属于溶液,故B错误;C. 面条不溶于水,不能形成均一、稳定的混合物,即不能形成溶液,故C正确;D. 白糖易溶于水,形成均一、稳定的混合物,属于溶液,故D错误;综合以上分析,本题应选C。
点睛:本题考查溶液的概念及形成溶液的条件,面条不溶于水,不能形成均一、稳定的混合物,即不能形成溶液。
下列有关说法正确的是( )
A.正丁烷的二氯代物有7种(不考虑立体异构)
B.组成为C5H10的苯的同系物,分子中所有碳原子一定共平面
C.乙醛和丙烯醛(CH2=CH-CHO)不是同系物,与足量H2 加成后的产物也不是同系物
D.用碳酸氢钠溶液可将乙酸、乙醇、苯区别开
D
【解析】A、正丁烷的结构简式为CH3CH2CH2CH3,根据定一移一,二氯代物有6种,故A错误;B、苯的同系物同时为CnH2n-6,C5H10不属于苯的同系物,故B错误;C、乙醛中不含碳碳双键,丙烯醛中含有碳碳双键,因此两者不是同系物,乙醛与氢气发生加成产物是CH3CH2OH,丙烯醛与氢气发生加成产物是CH3CH2CH2OH,两者属于同系物,故C错误;D、NaHCO3加入乙酸中,出现气泡,NaHCO3加入到乙醇中不出现分层,NaHCO3加入到苯中,出现分层现象,因此碳酸氢钠可以区分,故D正确。
下列各实验的叙述正确的是
| 选项 | 实验内容 | 实验目的或结论 |
| A | 以甲基橙作指示剂,用一定浓度的NaOH溶液滴定一定体积、一定浓度的草酸溶液[已知K1(H2C2O4)=5.4×10-2、K2(H2C2O4)=6.4×10-5] | 证明草酸是二元酸 |
| B | 某样品进行焰色反应时产生黄色火焰 | 该样品是钠盐 |
| C | 将溴水、苯、FeBr3混合于烧瓶中 | 制备溴苯 |
| D | 常温下,用pH计分别测定浓度均为0.1 mol/L的NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.A B.B C.C D.D
D
【解析】
分析:欲证明草酸是二元酸,可用一定浓度的NaOH溶液滴定一定体积、一定浓度的草酸溶液,根据消耗的n(NaOH)=2n(H2C2O4),证明草酸是二元酸,由于是强碱滴弱酸,滴定终点时溶液显碱性,选用酚酞为指示剂;焰色反应时产生黄色火焰,说明样品含有钠元素,不一定是钠盐;制备溴苯用液溴,不用溴水;通过测等浓度的NaClO溶液和CH3COONa溶液的pH,比较其大小,根据水解原理来比较HClO和CH3COOH的酸性强弱是可行之法。
详解:A.滴定终点时溶液显碱性,应选酚酞作指示剂,根据消耗的n(NaOH)=2n(H2C2O4),证明草酸是二元酸,故A错误;B. 焰色反应时产生黄色火焰,只能证明样品中含有钠元素,不能确定是钠盐,故B错误;C.制备溴苯应用液溴,而不是溴水,故C错误;D. 常温下,用pH计分别测定浓度均为0.1 mol/L的NaClO溶液和CH3COONa溶液的pH,pH越大溶液的碱性越强,对应的酸越弱,故D正确;综合以上分析,本题应选D。
点睛:本题考查对实验目的或结论的评价,答题时要注意试验细节,强碱滴定弱酸,应用酚酞作指示剂,而不能用甲基橙;焰色反应时产生黄色火焰,该样品不一定是钠盐;制备溴苯应用液溴,而不是溴水。
短周期元素W、X、Y、Z的原子数依次增加,由这些元素组成的常见物质的转化关系如图所示,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质能与沸水反应,且该单质可制造照明弹,f为固体单质。下列有关说法正确的是
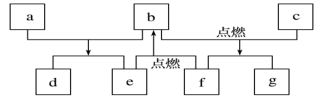
A.简单离子半径:Y>Z>X
B.元素的非金属性:W>X
C.X、Y两种元素组成的化合物只含离子键
D.最高价氧化物对应水化物的碱性:Y>Z
D
【分析】
根据题干信息,a、b、d、g为化合物,a为淡黄色固体,则a为过氧化钠;c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹,则Z为镁元素;由这些元素组成的常见物质的转化关系可知,若f为固体单质,则b为二氧化碳、f为碳、e为氧气、d为碳酸钠、g为氧化镁,短周期元素W、X、Y、Z的原子序数依次增加,则其分别为C、O、Na、Mg,据此分析解答问题。
【详解】
A.电子层结构相同的离子,核电荷数越大的半径越小,所以简单离子的半径X>Y>Z,A不正确;
B.元素的非金属性为O>C,B不正确;
C.X、Y两种元素组成的化合物有氧化钠和过氧化钠,其中氧化钠只含离子键、过氧化钠既有离子键又有共价键,C不正确;
D.Na的金属性强于Mg,故其最高价氧化物对应水化物的碱性较强,D正确;
答案选D。
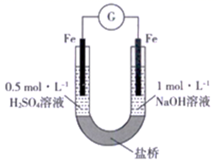
研究小组进行如下表所示的原电池实验:
| 实验编号 | ① | ② |
| 实验装置 |
|
|
| 实验现象 | 连接装置5 分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 左侧铁片表面持续产生气泡,连接装置5 分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A.两装置的盐桥中,阳离子均向右侧移动
B.实验①中,左侧的铜被腐蚀
C.实验②中,左侧电极的电极反应式为2H++ 2e-=H2↑
D.实验① 和实验②中,均有O2 得电子的反应发生
D
【解析】
A、①电子移动的方向从负极流向正极,即左侧铜为正极,右侧铜为负极,根据原电池工作原理,阳离子向正极移动,即向左侧移动,②5min前左侧铁片有气泡产生,说明左侧铁作正极,右侧铁作负极,根据原电池的工作原理,阳离子向正极移动,即向左侧移动,故A错误;B、根据A选项分析,实验①中左侧铜没有被腐蚀,右侧铜被腐蚀,故B错误;C、实验②,前5min,左侧铁片上有气泡产生,电极反应式为2H++2e-=H2↑,5min后,灵敏电流表指针发生偏转,说明正负极发生偏转,即左侧为负极,右侧为正极,即左侧电极反应式为H2-2e-=2H+,故C错误;D、实验①左侧电极反应式为O2+4H++4e-=2H2O,5min后,右侧铁片电极反应式为O2+2H2O+4e-=4OH-,故D正确。
本卷还有7题,登录并加入会员即可免费使用哦~

该作品由: 用户郝福中分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。