“液态阳光”是指由阳光、二氧化碳和水通过人工光合得到的绿色液态燃料。下列有关“液态阳光”的说法错误的是
A.CO2和H2O转化为“液态阳光”过程中同时释放能量
B.煤气化得到的水煤气合成的甲醇不属于“液态阳光”
C.“液态阳光”行动有利于可持续发展并应对气候变化
D.“液态阳光”有望解决全球化石燃料不断枯竭的难题
A
【解析】
A、“液态阳光”是指由阳光、CO2和水通过人工光合得到的绿色液态燃料,是将光能转化成化学能的过程,该反应为吸热反应,故A说法错误;
B、煤气化是由水蒸气与碳反应生成CO和H2,煤液化可以合成甲醇,不符合“液态阳光”的定义,煤气化得到水煤气合成的甲醇不属于“液态阳光”,故B说法正确;
C、“液态阳光”由阳光、CO2和水反应,可以解决温室气体,有利于可持续发展并应对气候变化,故C说法正确;
D、根据“液态阳光”的定义,“液态阳光”有望解决全球化石燃料不断枯竭的难题,故D说法正确;
下列化学用语的表述正确的是
A.钢铁吸氧腐蚀中的正极反应:4OH--4e-=2H2O +O2
B.由Na和Cl形成离子键的过程:![]()
C.NaHCO3的水解平衡:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
D.实验室制乙炔的反应:CaC2+H2O →CaO+C2H2
B
【解析】
A. 钢铁吸氧腐蚀中的正极发生氧气得电子的还原反应: O2+4e-+2H2O =4OH-,故A错误;
B. Na原子失去1个电子被Cl原子得到,形成的化合物为离子化合物,则由Na和Cl形成离子键的过程表示为:![]() ,故B正确;
,故B正确;
C. HCO3-结合水电离出的H+生成H2CO3,水解平衡的离子方程式为:HCO3-+H2O ![]() H2CO3+OH-,故C错误;
H2CO3+OH-,故C错误;
D. 碳化钙和水反应生成氢氧化钙和乙炔,化学方程式为:CaC2+2H2O →Ca(OH)2+C2H2↑,故D错误。
故答案选B。
下列有关物质性质与用途具有对应关系的是
A.SiO2熔点很高,可用于制造坩埚
B.NaOH能与盐酸反应,可用作制胃酸中和剂
C.Al(OH)3是两性氢氧化物,氢氧化铝胶体可用于净水
D.HCHO可以使蛋白质变性,可用于人体皮肤伤口消毒
A
【解析】
物质的性质决定物质的用途,据性质与用途的对应关系分析。
【详解】
A项:SiO2用于制造坩埚,利用了SiO2高熔点的性质,A项正确;
B项:虽然NaOH能与盐酸反应,但其碱性太强,不能作胃酸中和剂,B项错误;
C项:氢氧化铝胶体用于净水,是胶体的强吸附性,与其两性无关,C项错误;
D项:HCHO能使人体蛋白质变性,但其毒性太强,不能用于皮肤伤口消毒,D项错误。
本题选A。
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入苯酚显紫色的溶液:Cu2+、 NH4+、 Cl-、SCN-
B.无色透明的溶液:Na+、 Fe2+、![]() 、
、 ![]()
C.![]() =10-2 mol/L的溶液:K+、Na+、
=10-2 mol/L的溶液:K+、Na+、 ![]() 、CH3COO-
、CH3COO-
D.能使酚酞变红的溶液:Mg2+、 Ba2+、ClO-、 I-
C
【解析】
A. 加入苯酚显紫色的溶液说明含有Fe3+,SCN-与铁离子反应生成Fe(SCN)3,不能大量存在,A不符合题意;
B.含 Fe2+的溶液呈浅绿色,无色透明的溶液中不能存在,B不符合题意;
C. 根据公式可知,c(OH-)=10-2 mol/L的溶液,溶液呈碱性,离子相互间不反应,均能大量存在,C符合题意;
D. 能使酚酞变红的溶液显碱性,Mg2+与氢氧根生成Mg(OH)2沉淀,不能大量存在,D不符合题意;
答案为C。
下列实验装置用加热铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
A.制取并收集二氧化硫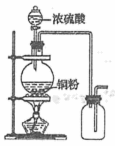
B.向反应后的混合物中加水稀释
C.过滤出稀释后混合物中的不溶物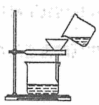
D.将硫酸铜溶液蒸发浓缩后冷却结晶
D
【解析】
A. 浓硫酸和铜反应需要加热,生成的二氧化硫的密度比空气密度大,且属于有毒气体,应采用向上排空气法,后加尾气处理装置,图中为向下排空气法,A错误;
B. 浓硫酸溶于水放出大量的热,浓硫酸的稀释均是把浓硫酸加入水中,并不断搅拌;由于反应后的混合物仍然可能含有浓硫酸,所以应把混合物向中水倾倒并不断搅拌,B错误;
C. 过滤时应使用滤纸,用玻璃棒引流,C错误;
D. 硫酸铜性质稳定,可用蒸发皿蒸发结晶,D正确。
答案为D。
本卷还有16题,登录并加入会员即可免费使用哦~

该作品由: 用户游婧婷分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。