湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图:
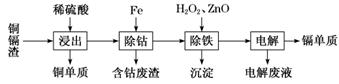
下表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.9 | 7.0 | 7.2 | 5.4 |
| 沉淀完全的pH | 3.2 | 9.0 | 9.5 | 8.2 |
已知浸出后的溶液中金属元素都以二价阳离子形式存在,请回答下列问题:
(1)为加快铜镉渣的“浸出”速率可采用的措施有________________________________(写出1条即可)。
(2)“除钴”中发生反应的离子方程式是__________________________________。
(3)“除铁”操作中加入H2O2发生反应的离子方程式___________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________。
(4)“电解”操作中,得到金属Cd的电极反应式是________________________。
(5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是__________________、过滤。
(1)加热或将铜镉渣磨成粉或适当增大硫酸浓度(写出1条即可,其它合理答案也可)
(2) Fe + Co2+ ==== Fe2+ + Co
(3) 2Fe2+ + H2O2 +2H+ ==== 2Fe3+ +2H2O ,3.2~5.4
(4) Cd2+ + 2e- ==== Cd
(5)蒸发浓缩,冷却结晶
以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
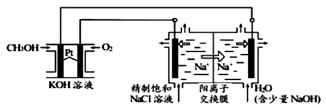
(1)CH3OH燃料电池放电过程中,电解质溶液的pH______(填“增大”、“减小”或“不变”),正极反应式为______。
(2)在阴极室水中加入少量的NaOH的作用是 ,产生的气体为: (化学式)。
(3)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的电极反应式为______。
(4)电解一段时间,从阴极处收集到的气体比阳极处收集到气体多10.08L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______mol。
(1) 减小 ,O2 + 4e- + 2H2O=== 4OH- (2) 增加溶液的导电性 ,H2
(3) Cl- - 5e- +2H2O === ClO2↑ + 4H+ (4) 1.5
常温下,10 mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示,请回答下列问题:
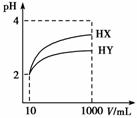
(1)10 mL pH=2的盐酸加水稀释到1000 mL,pH= 。
(2)物质的量浓度均为0.1 mol·L−1的NaX和NaY溶液,pH较大的是 (填化学式,下同),其中水的电离程度较小的是 。
(3)等体积,pH均为2的三种酸:①HX、②HY、③HCl分别被同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小分别为(填编号) 。
(4)H2Z是一种二元弱酸,常温下,0.1 mol·L−1的H2Z溶液中加入等体积pH=13的KOH溶液后,溶液的pH>7,原因可能是 。
(1) 4 (2) NaY , NaX (3) ②>①>③
(4) HZ—的水解程度大于HZ—的电离程度,溶液呈碱性
已知K、Ka、Kw、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是 。
a.它们的大小都随温度的升高而增大
b.它们都能反映一定条件下对应可逆过程进行的程度
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)已知25℃时CH3COOH和NH3·H2O电离常数相等,则该温度下CH3COONH4溶液的pH= ,溶液中离子浓度大小关系为 。
(3)硝酸铜溶液蒸干、灼烧后得到的固体物质是 。
(4)明矾净水原理 。(用离子方程式表示)
(5)已知在25℃时Ksp[AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1×10-12。25℃时,向浓度均为0.02mol·L-1的NaCl和Na2CrO4混合溶液中逐滴加入AgNO3溶液,先析出 (填化学式)沉淀,当两种沉淀共存时,![]() = 。
= 。
(1) b (2) 7 , c(NH![]() )=c(CH3COO—)>c(H+)=c(OH—)
)=c(CH3COO—)>c(H+)=c(OH—)
(3)CuO (4) Al3++3H2O![]() Al(OH)3(胶体)+3H+ (5) AgCl ,3.24×10-8。
Al(OH)3(胶体)+3H+ (5) AgCl ,3.24×10-8。
常温下,有两种溶液:①0.1 mol·L−1 CH3COOH溶液 ②0.![]() 1 mo
1 mo![]() l·L−1 CH3COONa溶液。
l·L−1 CH3COONa溶液。
(1)溶液①的pH______7(填“大于”、“小于”或“等于”),醋酸电离平衡常数Ka= (表达式)。
(2)溶液①②等体积混合后溶液呈______性,混合溶液的物料守恒关系为:________________________________。
(3)下列说法正确的是________(填序号)。
a.两种溶液中c(CH3COO−)都小于0.1 mol·L−1
b.两种溶液中c(CH3COO−)都等于0.1 mol·L−1
c.CH3COOH溶液中c(CH3COO−)小于CH3COONa溶液中c(CH3COO−)
(1) 小于 , ![]()
(2) 酸 , c(CH3COO—)+c(CH3COOH)=2c(Na+) (3) a c
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户北北分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。