某反应过程能量变化如图所示,下列说法不正确的是( )
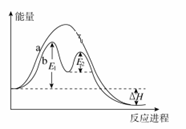
A.反应过程b有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,可改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2
D
对于:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是 ( )
A. 该反应的反应热为-5 800 kJ·mol-1,是放热反应
B. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-1
C. 该反应的ΔH与各物质的状态有关,与化学计量数也有关
D. 该式的含义:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5 800 kJ
B
往5mL 0.005 mol/L FeCl3溶液中滴加5mL 0.01 mol/L KSCN溶液,溶液呈红色,发生反应:
FeCl3+3KSCN![]() 3KCl+Fe(SCN)3 下列说法不正确的是 ( )
3KCl+Fe(SCN)3 下列说法不正确的是 ( )
A.往上述溶液中加入饱和Fe2(SO4)3溶液,溶液红色变深
B.往上述溶液中加入KCl溶液,平衡向左移动
C.往上述溶液中加入铁粉,溶液红色变浅
D.往上述溶液中加入NaOH溶液,溶液变成红褐色
D
合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H < 0
CO2(g)+H2(g) △H < 0
反应到达平衡后,为提高CO的转化率,下列措施中正确的是 ( )
A.增加压强 B.降低温度
C.增大CO的浓度 D.更换催化剂
B
密闭容器中发生反应:2X(g)+Y(s)![]() 2Z(g) ΔH<0,达到平衡时,下列说法正确的( )
2Z(g) ΔH<0,达到平衡时,下列说法正确的( )
A.减小容器体积,平衡正向移动 B.再加入Z,达平衡时Z的体积分数增大
C.再加入X,X的转化率减小 D.降低温度,Y的转化率增大
D
本卷还有17题,登录并加入会员即可免费使用哦~

该作品由: 用户覃霞分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。