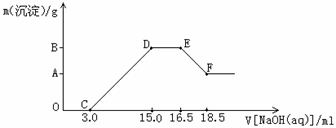
硝酸跟金属反应时,随着硝酸的浓度下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH3中的一种或几种。现有一定量铁粉和铝粉组成的混合物跟100ml稀硝酸充分反应,反应过程中无任何气体放出,在反应结束后的澄清溶液中,逐渐加入4.00mol/L的氢氧化钠溶液,加入氢氧化钠溶液的体积与产生沉淀的质量如图所示:
请回答:
(1)反应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因是:________________。
(2)跟硝酸反应后的产物中铁元素的化合价是__________。
(3)图形中DEF先平后下折的原因是_________________________________________。
(4)纵坐标中A点的数值是________________。原稀硝酸的浓度是______________。
答案
(1)HNO3过量,NaOH优先中和过量的HNO3
(2)+3
(3)NaOH先与NH4NO3作用产生NH3后,再溶解Al(OH)3
(4)0.856 g 0.72mol/L

 ×100%
×100%


 ,c为溶质的物质的量的浓度,单位mol·L-1,ρ为溶液密度,单位为g·cm-3,ω为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1。
,c为溶质的物质的量的浓度,单位mol·L-1,ρ为溶液密度,单位为g·cm-3,ω为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1。 或
或
 ;
; 。
。