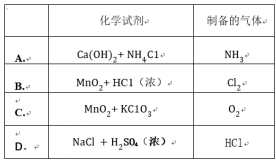
下图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
(1)⑥中发生反应的化学方程式为_______________________________。
(2)①中的实验现象为______________,此实验证明SO2是_________________气体。
(3)②中的品红溶液_________________,证明SO2有_________________性。
(4)③中的实验现象是_________________,证明SO2有_________________性。
(5)④中的实验现象是_________________,证明SO2有_________________性。
(6)⑤的作用是_________________,反应方程式为_________________。
答案
解析:Na2SO3是弱酸盐,能与H2SO4发生复分解反应;H2SO3是弱酸,能使石蕊试液变红色;SO2具有漂白作用,可使品红褪色;SO2具有氧化性,能与还原性气体发生反应,生成S沉淀:2H2S+SO2══2H2O+3S↓;SO2具有还原性,能将氯水还原为无色的HCl:SO2+Cl2+2H2O══H2SO4+2HCl;SO2是酸性气体,可被NaOH吸收,反应生成盐和水。
答案:(1)Na2SO3+H2SO4══Na2SO4+H2O+SO2↑
(2)变红色 酸性
(3)褪色 漂白
(4)变浑浊 氧化
(5)褪色 还原
(6)吸收剩余SO2,防止SO2污染空气 SO2+2NaOH══Na2SO3+H2O(或NaOH+SO2══NaHSO3)