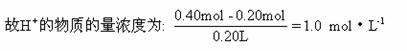将8.8 g FeS固体置于200 mL 2.0 mol・L-1的盐酸中,以制备H2S气体.反应完全后,若溶液中H2S的浓度为0.10 mol・L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况).
(2)溶液中Fe2+和H+的物质的量浓度(摩尔浓度).
答案
根据方程式FeS+2H+=Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准.
![]()
(1)共生成H2S 0.10mol.在溶液中溶解的物质的量为:
0.10 mol・L-1×0.20 L=0.020 mol
所以收集到H2S气体的物质的量为:0.10 mol-0.020 mol=0.08 mol
收集到H2S气体的体积(标准状况)为: 22.4 L・mol-1×0.08 mol=1.8 L
![]()
消耗掉H+0.20 mol,反应前H+的物质的量为:2.0 mol・L-1×0.20 L=0.40 mol