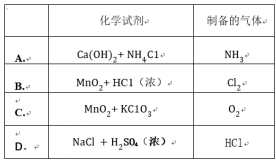
(1)你能排出几种方式?排出每种方式的理由是什么?
(2)通过对你所排出方式的对比,你认为哪种最合理?理由是什么?
(3)在你所选出的最佳排布方式中,元素的原子结构的变化规律是怎样的?
(4)根据原子半径大小的决定因素,试着由原子结构的变化规律进一步推导出原子半径的变化规律,并与教材上的数据对比看是否一致。
(5)元素的主要化合价与元素原子的最外层电子数有关,试由原子结构的变化规律进一步推导出元素主要化合价的变化规律,并与教材上的数据对比看是否一致。
(6)元素的性质主要体现在得电子能力与失电子能力两个方面,试由原子结构和原子半径的变化规律进一步推导出元素性质的变化规律。
答案
解析:我们对1—18号元素的原子结构示意图是很容易画出的,根据电子层数不同分组排列也是容易做到的,不容易确定的主要是两种元素:氢和氦,氢可以放在锂的上边(最外层电子数相同),也可以放在氟的上边(得一个电子就可以达到稳定结构);氦可以放在铍的上边(最外层电子数相同),也可以放在氖的上边(都是已经达到稳定结构的元素),所以1—18号元素有四种排布方式。在这四种方式中,“氢放在锂的上边,氦放在氖的上边”的排布方式最为合理,原因是:氢虽然可以形成H+和H-两种形式的离子,但是H+比H-常见和稳定,氢更类似于锂、钠等元素,并且使排列也有一定的对称性,所以氢放在锂的上边更合理;元素是否达到稳定结构对其性质影响很大,氦的性质与氖非常相似,而与铍、镁却相差很远,所以氦放在氖的上边更合理。在选出的最佳排列方式中,通过核外电子排布的电子层数和最外层电子数两个方面总结原子结构的变化规律。根据“电子层数相同时,质子数越多,原子核对外层电子的吸引力越强”这一规律可以分析出原子半径的变化规律。元素的主要化合价的变化规律可以通过原子的最外层电子数的变化规律推出。元素的性质与元素原子核对外层电子的吸引力有直接关系,而后者又取决于电子层数和质子数。
答案:1—18号元素的原子结构示意图依次为:

(1)据电子层数相同的元素排成行,最外层电子数相等的元素排成列可以得到A方式;He的最外层电子数虽然都是2,与Be、Mg相同,但意义却不一样,第一层上填充2个电子已经达到了稳定结构,而其他层上填充2个电子就都没有达到稳定结构,这样即可以得到D方式;H也有类似于F和Cl的结构,即得到一个电子就可以达到稳定结构,这样就可以得到B方式或者C方式。
A方式
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
B方式
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
C方式
H
He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
D方式
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
(2)通过四种方式的元素原子结构示意图的对比,可知He已经达到稳定结构,应该与同样达到稳定结构的Ne和Ar处于同一列;因为H+比H-既常见又稳定,H更类似于Li、Na等元素,并且使排列也有一定的对称性,所以H放在Li的上边更合理;所以D方式是最合理的。
(3)随着元素原子序数(即质子数)的递增,原子核外电子的排布(具体说应该是最外层电子的排布)呈现周期性变化。
(4)电子层数相同时,随着元素原子序数的递增,质子数增加,原子核对外层电子的吸引力增强,电子有向中心收缩的趋势,原子半径减小(稀有气体元素除外)。不考虑稀有气体元素,当具有某电子层数的最后一种元素过渡到下一种元素时,电子层数增加了一层而质子数只增加了2,这时原子半径会突然增大,而后再逐渐减小,所以元素原子半径随着元素原子序数的递增也是呈周期性变化的。
(5)元素的最高正价一般就是最外层电子全部失去或者全部向其他原子偏移所造成的结果,元素的负价就是达到最外层稳定结构(2个或者8个)还需要得到或者偏移进来的电子数。元素最高正价一般就等于最外层电子数,负价一般等于8(或2)减去最高正价,所以元素主要化合价随着元素原子序数的递增也是呈周期性变化的。
(6)类似于对原子半径递变规律的分析,元素的得电子能力和失电子能力随着元素原子序数的递增也是呈周期性变化的。