粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料 ( 主要含 和
等 ) 提铝的工艺流程如下:
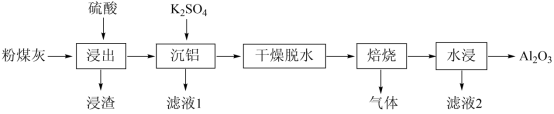
回答下列问题:
(1)“ 浸出 ” 时适当升温的主要目的是 , 发生反应的离子方程式为 。
(2)“ 浸渣 ” 的主要成分除残余 外,还有 。实验测得,
粉煤灰 (
的质量分数为
) 经浸出、干燥后得到
“ 浸渣 ”(
的质量分数为
) ,
的浸出率为 。
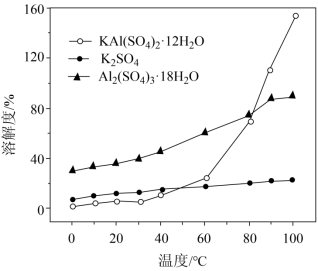
(3)“ 沉铝 ” 时,体系中三种物质的溶解度曲线如下图所示,加入 沉铝的目的是 , “ 沉铝 ” 的最佳方案为 。
(4)“ 焙烧 ” 时,主要反应的化学方程式为 。
(5)“ 水浸 ” 后得到的 “ 滤液 2” 可返回 工序循环使用。
答案
(1) 提高浸出率 ( 或提高浸出速率 )
(2) 和
84%
(3) 使更多的铝元素转化为晶体析出,同时保证晶体纯度 高温溶解再冷却结晶
(4) 或
(5) 沉铝
【分析】粉煤灰为原料 ( 主要含 SiO 2 、 Al 2 O 3 和 CaO 等 ) 加入硫酸,浸渣为二氧化硅、硫酸钙,加入硫酸钾,产生复盐明矾沉铝,干燥脱水,焙烧产生氧化铝、硫酸钾和二氧化硫或三氧化硫气体,水浸除去硫酸钾,得到氧化铝。
【详解】( 1 )温度高速率大, “ 浸出 ” 时适当升温的主要目的是提高反应速率,提高浸出率; Al 2 O 3 和 H 2 SO 4 发生反应生成 Al 2 (SO 4 ) 3 和 H 2 O ,离子反应方程式为 Al 2 O 3 +6H + =2Al 3+ +3H 2 O ;
故答案为:提高浸出率 ( 或提高浸出速率 ) ; Al 2 O 3 +6H + =2Al 3+ +3H 2 O 。
( 2 ) “ 浸渣 ” 的主要成分除残余 Al 2 O 3 外,还有二氧化硅、硫酸钙; 5.0g 粉煤灰 Al 2 O 3 的质量为 5.0g×30%=1.5g , 3.0g“ 浸渣 ”Al 2 O 3 的质量为 3.0g×8%=0.24g ,则 Al 2 O 3 的浸出率为 ;
故答案为: SiO 2 和 CaSO 4 ; 84% 。
( 3 )根据沉铝体系中, Al 2 (SO 4 ) 3 ·18H 2 O 溶解度最大, KAl(SO 4 ) 2 ·12H 2 O 溶解度最小,更容易析出,加入 K 2 SO 4 沉铝的目的是更多的使 Al 2 (SO 4 ) 3 转化为 KAl(SO 4 ) 2 ·12H 2 O ,使更多的铝元素转化为晶体析出,同时保证晶体纯度; KAl(SO 4 ) 2 ·12H 2 O 溶解度受温度影响较大, “ 沉铝 ” 的最佳方案为高温溶解再冷却结晶;
故答案为:使更多的铝元素转化为晶体析出,同时保证晶体纯度;高温溶解再冷却结晶。
( 4 ) “ 焙烧 ” 时, KAl(SO 4 ) 2 分解为 K 2 SO 4 、 Al 2 O 3 和 SO 3 或 K 2 SO 4 、 Al 2 O 3 、 SO 2 和 O 2 ,反应方程式为 2KAl(SO 4 ) 2 K 2 SO 4 +Al 2 O 3 +3SO 3 ↑ 或 4KAl(SO 4 ) 2
2K 2 SO 4 +2Al 2 O 3 +6SO 2 ↑+3O 2 ↑ ;
故答案为: 2KAl(SO 4 ) 2 K 2 SO 4 +Al 2 O 3 +3SO 3 ↑ 或 4KAl(SO 4 ) 2
2K 2 SO 4 +2Al 2 O 3 +6SO 2 ↑+3O 2 ↑ 。
( 5 ) “ 水浸 ” 后得到的 “ 滤液 2” 成分为 K 2 SO 4 ,可在沉铝工序循环使用;
故答案为:沉铝。
